
某研究性学习小组欲利用下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。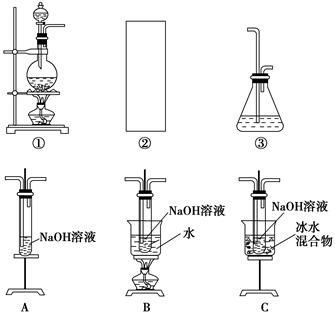
相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处:____________。
(2)部分学生认为上述装置存在缺点,他们指出在①②装置之间应增加如D所示的装置,你认为D中所盛液体是________,其作用是________________________________________。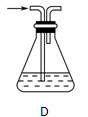
(3)该小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因:_________________________________________________________________。
第二步,该小组的同学选用了紫色石蕊试液对次氯酸钠的性质进行探究。请你帮助他们完成下表:
| 实验操作 | 预期现象 | 结论 |
| | | |
科目:高中化学 来源: 题型:实验题
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略.
(一)甲同学认为当D处盛放V2O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现.
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学反应方程式是:__________,C装置中盛放的液体药品的名称是______________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察__________得知.
(3)本实验在设计上_________(填有、无)缺失之处?若有请给出改进方案。(若无,此问可不答)
(二)乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅.
(4)写出乙同学认为的D装置中发生反应的化学方程式_________________________________。
(5)对于A处,乙认为不需加热装置。则A处仪器中分别放置的药品为:分液漏斗中____________圆底烧瓶中_________
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基本一致,那么C处的广口瓶应改为__________所装药品为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题: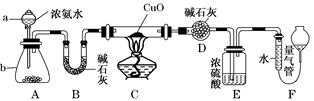
(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A还可制取的无色气体是________(填字母)
| A.Cl2 | B.O2 | C.CO2 | D.NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是__________________,其中发生反应的化学方程式为______________;
(2)实验过程中,装置B、C中产生的现象分别是___________、___________,这些现象分别说明SO2具有的性质是___________和___________;装置B中发生反应的离子方程式为_________________________________________________。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象____________;
(4)尾气可采用______________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质:
(1)写出甲中反应的离子方程式:_________________________________,
乙中的现象是_________________________________________________,
可证明NO2的氧化性;在丙中鼓入空气后的现象是_______________,可证明NO的还原性。
(2)实验前丙中充满水的作用是___________________________________
(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是___________________________________________。
你认为怎样才能准确证明NO2的氧化性?____________________________________(简要回答出原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
(1)用图所示装置制取Na2S2O3,其中NaOH溶液的作用是 。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。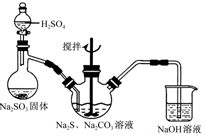
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示剂,滴定终点的现象是 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的质量分数会 (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为: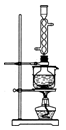
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组设计了下列装置进行氨的催化氧化实验。
(1)常温下,用5.8 mol/L的氨水时实验现象明显,现用浓氨水配制该浓度的氨水480mL,需要烧杯、玻璃棒,还需要的玻璃仪器有 。
(2)甲处药品的名称为_____________。
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是_____(填“吸”或“放”)热反应,化学方程式为 ;乙处加入无水氯化钙,烧瓶中发生反应的化学方程式为___ ;锥形瓶中产生的现象为 _。
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生的现象为 。
(5)现用镁与石墨作电极,浓氯化铵溶液作电解液构成原电池,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。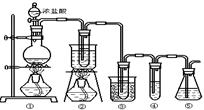
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH溶液.并置于热水浴中;③的试管里盛有15mL 8%NaOH溶液.并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为___色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为___色 | _________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为 ;
装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 ;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 ;
| | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com