
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
(1)用图所示装置制取Na2S2O3,其中NaOH溶液的作用是 。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。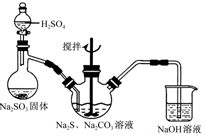
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示剂,滴定终点的现象是 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的质量分数会 (填“偏高”、“偏低”或“不变”)。
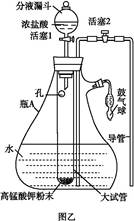
(3)本实验对Na2S的纯度要求较高,利用图所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为: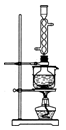
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
(1)吸收SO2尾气,防止污染空气 NaCl(或S,或NaCl、S)
(2)①IO3-+5I-+6H+= 3I 2+3H2O 淀粉
②溶液由无色变为蓝色,且半分钟内不褪色
③偏低
(3)将所得滤液冷却结晶,过滤
解析试题分析:(1)实验中使用污染性气体SO2,防止其逸出污染空气,故用碱液吸收;浓盐酸引入了氯离子,故有NaCl杂质,还可能有硫元素的归中反应产物S;(2)①发生归中反应,IO+5I-+6H+=3I2+3H2O;有碘单质参与或生成的反应均用淀粉做指示剂;实验是用碘溶液滴定Na2S2O3·溶液,滴定前溶液为无色,滴定终点后碘与淀粉显蓝色,且要保证试剂充分反应故应让现象半分钟内不褪色;③该现象会有Na2S2O3没反应完全,导致碘标准液量偏少,计算出Na2S2O3也偏少,结果偏低;(3)根据信息提示Na2S提纯应在温度高的情况下溶解于酒精,趁热过滤除去杂质,然后冷却结晶过滤洗涤干燥得到纯净的产品。
考点:考查综合实验物质的制备与分析有关问题。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:实验题
某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题: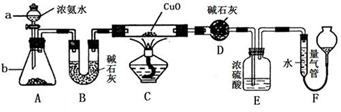
(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为验证NO2的氧化性和NO的还原性,设计了如下装置制取NO2和NO,并验证其性质: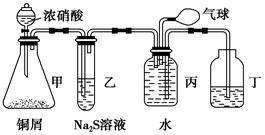
(1)写出甲中反应的离子方程式:______________________________________,乙中的现象是_____________________________________________________,可证明NO2的氧化性;在丙中鼓入空气后的现象是___________________________________________________,可证明NO的还原性。
(2)实验前丙中充满水的作用是________________________________________(用反应的化学方程式和简要文字回答)。
(3)小华对上述实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是__________________________________________________________________。你认为怎样才能准确证明NO2的氧化性?________________________________________(简要回答出原理和现象即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。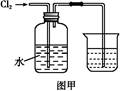
(1)氯水需临时配制的原因是 (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。
②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A ,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组欲利用下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。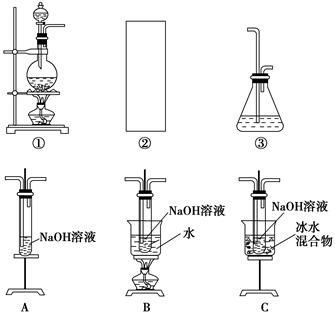
相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处:____________。
(2)部分学生认为上述装置存在缺点,他们指出在①②装置之间应增加如D所示的装置,你认为D中所盛液体是________,其作用是________________________________________。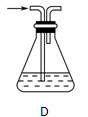
(3)该小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因:_________________________________________________________________。
第二步,该小组的同学选用了紫色石蕊试液对次氯酸钠的性质进行探究。请你帮助他们完成下表:
| 实验操作 | 预期现象 | 结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。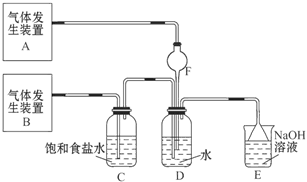
(1)气体发生装置A产生的气体是_____________。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:①氯化铁溶液;②氯化亚铁溶液;③硫氰化钾溶液;④苯酚溶液;⑤品红溶液; ⑥酸性高锰酸钾溶液
Ⅰ.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入____________(选填一个序号)试剂,实验现象是: 。
Ⅱ.若SO2过量:取适量D中溶液滴加至盛有____________(选填一个序号)的试管内,实验现象是:__________________________________。
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
如图是某研究性学习小组设计的SO2与Na2O2反应的探究装置.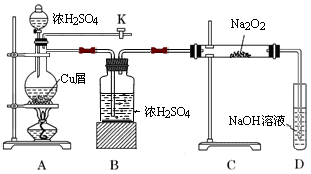
(1)实验开始时,打开旋塞K,通入N2排尽整套装置中的空气,关闭旋塞K。点燃酒精灯,A中反应的化学方程式是 。
(2)B装置的作用是 。
(3)反应过程中,观察到:A中出现黑色不溶物;C中固体由淡黄色逐渐至完全转化为白色;若将带火星木条伸入D试管口内,火星显得更明亮。
①停止加热后,再通入N2至整套装置冷却,其目的是 。
②取少量C中白色固体,溶于蒸馏水得无色溶液W 。若向W中滴加几滴酸性KMnO4溶液,振荡,紫色褪去;若向W中加入用盐酸酸化的BaCl2溶液,出现大量白色沉淀;则说明C中白色固体有 。
③D装置中发生反应的离子方程式是 。
④过滤出A装置中的黑色不溶物,洗涤后将其溶于浓硝酸,得到蓝色溶液并产生红棕色气体;向蓝色溶液中滴加BaCl2溶液,产生白色沉淀;则黑色物质可能是___________。
a.Cu b. CuO c.CuS d.Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组按下图所示装置进行探究实验。
请回答下列问题:
(1)装置A中发生反应的化学方程式为 。
(2)实验过程中,装置B发生的现象是 ,发生反应的离子方程式为 。
(3)装置C中发生的现象是 ,这说明SO2具有的性质是 。
(4)装置D的目的是探究SO2与品红作用的稳定性,请写出实验操作及现象
。
(5)试设计实验验证装置B溶液是否含有SO42- 。
(6)试在框图内画出SO2尾气处理装置图。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。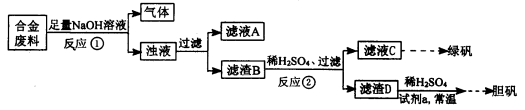
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com