
ijʵ��С�����������װ�ý��а��Ĵ�����ʵ�顣
��1�������£���5��8 mol/L�İ�ˮʱʵ���������ԣ�����Ũ��ˮ���Ƹ�Ũ�ȵİ�ˮ480mL����Ҫ�ձ���������������Ҫ�IJ��������� ��
��2���״�ҩƷ������Ϊ_____________��
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��_____��������š����ȷ�Ӧ����ѧ����ʽΪ ���Ҵ�������ˮ�Ȼ��ƣ���ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ___ ����ƿ�в���������Ϊ _��
��4�����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в���������Ϊ ��
��5������þ��ʯī���缫��Ũ�Ȼ����Һ�����Һ����ԭ��أ������ĵ缫��ӦʽΪ ��
��1����Ͳ����ͷ�ιܡ�500mL����ƿ ��2�֣�ȱһ���1�֣�
��2����ʯ�ң�2�֣���
��3�����ȷ�Ӧ��1�֣��� 4NH3��5O2 4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
��4���к���ɫ�������ɣ��������̣�2�֣���1�֣�
��5��2 NH4++ 2e����2NH3��+H2����2�֣���
���������������1������һ�����ʵ���Ũ�ȵİ�ˮ����Ҫ������Ͳ��ȡŨ��ˮ����Һ���480 mL����Ҫ500 mL����ƿ������õ���ͷ�ιܶ��ݣ���2�����ﰱ���ü�ʯ�ң���3����Ԥ�ȣ�������Ӧ��Ȼ��ֹͣ���ȣ���Ӧ��Ȼ���Խ��У�˵���÷�Ӧ�Ƿ��ȷ�Ӧ�����Ĵ���������NO��ˮ��NO������ƿ��������Ӧ����NO2����ɫ���壬��ƿ�е��ܿ������ݲ�����ͬʱ��Һ��Ϊ��ɫ��Һ���Ϸ����ֺ���ɫ���壻��4�����ȱ���Ҵ�����ˮ�Ȼ��Ƶĸ��NO��ˮ�Ͱ����ͻ������ƿ�У�NO���������ɺ���ɫ����NO2��NO2��ˮ��Ӧ�������ᣬ�����백����Ӧ��������粒��壬�ῴ�����̣���5���������¹���ԭ��أ������Ϊˮ�������Ե��Ȼ����Һ������Ϊþʧ���ӣ�������H+ �õ��ӣ�OH-���࣬���������Լ��ԣ�������εļ�⣬�а����ų�����������ӦΪ��2 NH4++ 2e����2NH3��+H2����
���㣺�����Ĵ�������������������ʣ����缫��Ӧʽ��д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�Ʊ�����þ��װ��ʾ��ͼ���£�
�ش��������⣺
(1)���װ�������Եķ�����_______________________________________��
a��������________��b��������________��
(2)д��NaNO2��(NH4)2SO4��Ӧ�Ʊ������Ļ�ѧ����ʽ______________________________��
(3)C��������______________________________________��
D��������_______________________________________��
�Ƿ����C��D��λ�öԵ���˵������____________________________��
(4)д��E�з�����Ӧ�Ļ�ѧ����ʽ______________________________��
(5)���û�ѧ����ȷ���Ƿ��е���þ���ɣ��������Ƿ���δ��Ӧ��þ��д��ʵ�����������__________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij��ѧ��ȤС��Ϊ��̽��ijЩ���������,�������ͼ��ʾ��ʵ��װ�á�ʵ��ʱ��A��D�в���������ͬʱͨ��C�С�(KΪֹˮ�У����ּг���������ȥ)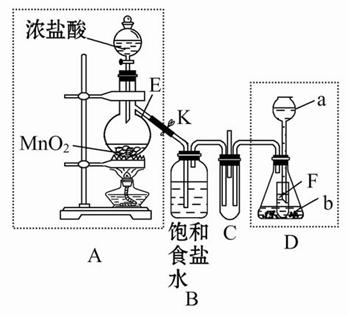
�ش��������⣺
(1)����ʵ��ǰ���A����װ�������Եķ����ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
(2)����E�������ǣߣߣߣߣߣߣ���ƿ��С�Թ�F�������ǣߣߣߣߣߣߡ�
(3)��b����ʯ�ң�a�ǣߣߣߣߣߣ�ʱ����C���а��̲�����д�����ɰ��̵Ļ�ѧ����ʽ�ߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
(4)��a����������Ϊ75%�����ᣬb���������Ʒ�ĩ����C��ʢ������BaCl2��Һʱ��д��C�з�����Ӧ�����ӷ���ʽ���ߣߣߣߣߣߣߣߣߣߣߣߡ�
(5)�ӻ����ĽǶȳ���������ʵ��װ������Ҫ�Ľ����ǣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߣߡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij�о���ѧϰС������������װ����ȡ�����������ƣ�����һ��̽���������ƵĻ�ѧ���ʡ�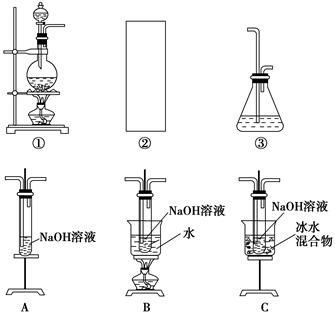
������ϣ���ӦCl2��2NaOH=NaClO��NaCl��H2O���ڷ��ȷ�Ӧ���¶��Ը�ʱ�㷢������Ӧ3Cl2��6NaOH=NaClO3��5NaCl��3H2O��
��1����ȡ����ʱ������ƿ�м���һ�����Ķ������̣�ͨ��____________����д�������ƣ�����ƿ�м���������Ũ���ᡣ����װ��A��B��C��ѡ��һ�����ʵ�װ�÷��ڢڴ���____________��
��2������ѧ����Ϊ����װ�ô���ȱ�㣬����ָ���ڢ٢�װ��֮��Ӧ������D��ʾ��װ�ã�����ΪD����ʢҺ����________����������________________________________________��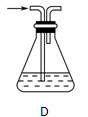
��3����С��Բ�Ʒ�����ʽ���������̽����
��һ��������pH��10�����������ӷ���ʽ����ԭ��_________________________________________________________________��
�ڶ�������С���ͬѧѡ������ɫʯ����Һ�Դ������Ƶ����ʽ���̽�������������������±���
| ʵ����� | Ԥ������ | ���� |
| | | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��֪Cl2�ͼ���Һ�ڲ�ͬ�����£��õ��IJ��ﲻͬ��ij��ȤС������ͼ��ʾװ����ȡ����ء��������ƺ�̽����ˮ�����ʡ���3Cl2+6KOH KClO3+5KCl+3H2O ��
KClO3+5KCl+3H2O ��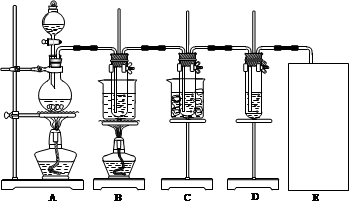
ͼ�У�AΪ��������װ�ã�B���Թ���ʢ��15 mL 30% KOH��Һ��������ˮԡ�У�C���Թ���ʢ��15 mL 8% NaOH��Һ�������ڱ�ˮԡ�У�D���Թ��������ɫʯ����Һ������д���пհף�
��1����ȡ����ʱ����Բ����ƿ�����һ�������Ķ������̣�ͨ�� (����������)��Բ����ƿ�м���������Ũ���ᡣװ��A�з�Ӧ�����ӷ���ʽΪ ����Ҫ����ƿ�м����Ƭ�� ��ѡ�����Ҫ����������Ҫ������
��2����Ӧ��������ƿ�����Һ ��
Aһ�������ԣ�B���������ԣ�Ҳ����Ϊ���ԣ�Cֻ�������ԣ�Dֻ�л�ԭ�ԣ�E�������������л�ԭ��
��3����Ӧ��ϣ�B�Թ�����������������������ȴ���д�������������ͼ�з��ϸþ����ܽ�����ߵ��� (������ĸ)����B���Թ��з�����þ�������õ��IJ��������� ��
��4����С��ͬѧ�����Ƶõ�����ز���ƫ�ͣ����ܵ�һ��ԭ����Cl2�к���HCl���塣�Դ��������ͨ���Ľ�ʵ��װ�õķ������б��⡣������ ��
��5��ʵ���пɹ۲쵽D���Թ�����Һ����ɫ����ɫ�ȱ�Ϊ_________ɫ�����ձ�Ϊ________ɫ��
��6��Cװ���з�Ӧ��ϵ�������______________________________________________��
��7������װ��ͼ�����л���ȱ�ٵ�ʵ��װ�ã���ע���Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��ͼ��ij�о���ѧϰС����Ƶ�SO2��Na2O2��Ӧ��̽��װ�ã�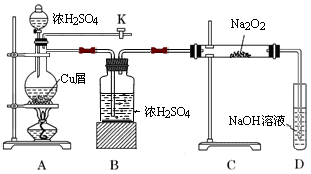
��1��ʵ�鿪ʼʱ��������K��ͨ��N2�ž�����װ���еĿ������ر�����K����ȼ�ƾ��ƣ�A�з�Ӧ�Ļ�ѧ����ʽ�� ��
��2��Bװ�õ������� ��
��3����Ӧ�����У��۲쵽��A�г��ֺ�ɫ�����C�й����ɵ���ɫ������ȫת��Ϊ��ɫ������������ľ������D�Թܿ��ڣ������Եø�������
��ֹͣ���Ⱥ���ͨ��N2������װ����ȴ����Ŀ���� ��
��ȡ����C�а�ɫ���壬��������ˮ����ɫ��ҺW ������W�еμӼ�������KMnO4��Һ������ɫ��ȥ������W�м����������ữ��BaCl2��Һ�����ִ�����ɫ��������˵��C�а�ɫ������ ��
��Dװ���з�����Ӧ�����ӷ���ʽ�� ��
�ܹ��˳�Aװ���еĺ�ɫ�����ϴ�Ӻ�������Ũ���ᣬ�õ���ɫ��Һ����������ɫ���壻����ɫ��Һ�еμ�BaCl2��Һ��������ɫ���������ɫ���ʿ�����___________��
a��Cu b�� CuO c��CuS d��Cu2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
���������һ�ֵ��͵�ǿ��������������ʵ���һ����ڻ��������ж�����Ҫ��Ӧ�á�
��ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ���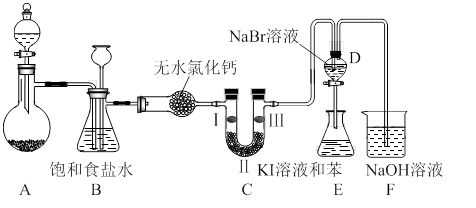
��1���Ʊ�����ѡ�õ�ҩƷΪ��������غ�Ũ���ᣬ��Ӧ�����ӷ���ʽΪ�� ��
��2��װ��B�������� �����ʵ�����ʱC�п��ܷ�����������д����������ʱB�е����� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C��I��II��III���η��� ����ѡa��b��c��
| | a | b | c |
| I | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
| II | ��ʯ�� | Ũ���� | ��ˮ�Ȼ��� |
| III | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ijʵ��С����̽��SO2��Cl2�ܷ�����Ӧ���������ͼ��ʾ��ʵ��װ�ý���ʵ�顣
��1��װ��A�еķ�ӦΪ2KMnO4+16HCl(Ũ) ="=" 2KCl+2MnCl2+5Cl2��+8H2O����Ӧ�е��������� ������71 g Cl2ת�Ƶĵ����� mol��
װ��C������SO2����Ӧ�Ļ�ѧ����ʽ�� ��
��2��װ��B��պ��NaOH��Һ������������ ��
��3����A��C�з�Һ©���Ļ�����һ��ʱ���رջ���������Ӧ��ȫ��С��ͬѧ�ּ�������ʵ�顣
�ټ�ͬѧȡ����B����Һ���Թ��У������еμ�����AgNO3��Һ���а�ɫ�������ɡ���ͬѧ�ɴ���ΪSO2��Cl2�����˷�Ӧ�������Ǹ÷�Ӧ�������� �������ӷ��ţ���
����ͬѧ��Ϊ��ͬѧ�Ľ��۲���������ΪA�����ɵ�Cl2�л������ʣ�Ӧ����װ��A��B������һ��Ȼ���ٰ���ͬѧ�ķ������ɵõ���ȷ���ۡ�
��ͬѧ��ΪCl2�л��е������� ��ϴ��ƿ��ʢ���Լ��������� ��
�� ��ͬѧ����Ϊ�ס�����λͬѧ�Ľ��۾�����������ͬѧȡ����B����Һ���Թ��У������еμ�������ҺX���а�ɫ�������ɣ���ɵó����ۣ���SO2��Cl2ͬʱͨ��ˮ�У����Է�����Ӧ����ҺX�� ����ѡ����ţ���
A��BaCl2��Һ B��Ba (OH)2��Һ C��Ba (NO3)2��Һ D��Ʒ����Һ
SO2��Cl2ͬʱͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij��ѧ��ȤС��Ϊ̽��SO2�����ʣ�����ͼ��ʾװ�ý���ʵ�顣
��֪��Na2SO3��H2SO4(Ũ) Na2SO4��SO2����H2O
Na2SO4��SO2����H2O
��ش��������⣺
��1��װ��A��ʢ��Ũ��������������� ��
��2��ʵ������У�C�е������� ��˵��SO2���� �ԡ�
��3��ʵ������У��۲쵽װ��B�г��������Եİ�ɫ������Ϊ̽���ð�ɫ�����ijɷ֣���С��ͬѧ����������ʵ�飺
����ʵ����ʵ�жϸð�ɫ�����ijɷ��� ���ѧʽ���������ð�ɫ������ԭ������� ������ĸ��ţ���
a��BaSO3�Ȳ�����ˮҲ��������
b��BaCl2��Һ�п����ܽ�������
c��BaCl2��Һ�п��ܻ���NaOH
d����A�Ƶõ�SO2�����п��ܻ�������
��4��д��B�в�����ɫ���������ӷ���ʽΪ��____________________________
��5�������װ��A�е�ŨH2SO4����ŨHNO3���Դ�ʵ���Ƿ���Ӱ�첢������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com