
【题目】现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因_____________________ (多选题)
A.定容时液面低于刻度线
B.未冷却到室温就定容
C.定容时液面高于刻度线
D.量取浓硫酸时俯视读数
【答案】②⑥⑦ 500 mL容量瓶 5.4 mL ① AB
【解析】
浓硫酸稀释时,用量筒量取浓硫酸置于盛有少量水的烧杯中,冷却后沿玻璃棒转移到500 mL的容量瓶中,洗涤烧杯和玻璃棒2-3次,将洗涤液也注入容量瓶中,向容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水,直至凹液面最低点与刻度线相切,盖上塞子,摇匀,溶液配制完成,据此分析作答。
(1)由分析可知,在配制稀H2SO4时,需要量筒、烧杯、玻璃棒、500 mL容量瓶、胶头滴管,不需使用的仪器是烧瓶、托盘天平和药匙;
(2)由稀释定律有V浓=![]() =
=![]() =0.0054L=5.4mL,量取浓硫酸时应选用10mL的量筒;
=0.0054L=5.4mL,量取浓硫酸时应选用10mL的量筒;
(3)A.定容时液面低于刻度线,溶液体积偏小,导致浓度偏高,A项正确;
B.未冷却到室温就定容,导致溶液体积偏小,导致浓度偏高,B项正确;
C.定容时液面高于刻度线,溶液体积偏大,导致浓度偏低,C项错误;
D.量取浓硫酸时俯视读数等,使溶质的物质的量偏小,导致浓度偏低,D项错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】在0.1L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
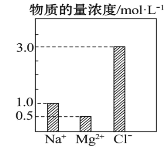
A.NaCl的物质的量为0.1mol
B.溶质MgCl2的质量为4.75g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1L,稀释后溶液中的Na+物质的量的浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
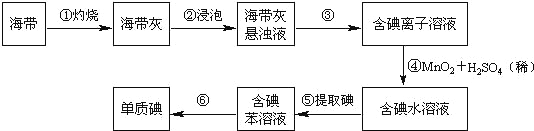
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后________(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请写出下列反应的离子方程式:
(1)NaOH与HCl反应:________________
(2)Zn与稀H2SO4反应:________________
(3)Na2SO4与BaCl2反应:________________
(4)CaCO3与稀HCl反应:________________
(5)CuSO4与Fe反应:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
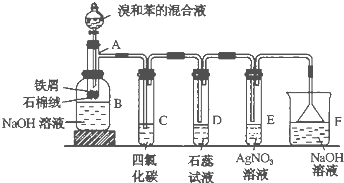
填写下列空白:
①试管A中的反应方程式为______。
②试管C中四氯化碳的作用是:______,反应开始后,观察到D试管中的现象为:___ 。
③在上述整套装置中,具有防倒吸的仪器有______(填字母)。
④反应完毕后,将B瓶中的液体取出,经过_____(填分离操作的名称)可获得粗溴苯,向粗溴苯中加入无水氯化钙,其目的是____。
⑤经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是______。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.运用已学知识完成下列计算:
(1)0.5 mol CH4的质量是________,在标准状况下的体积为________。
(2)3.1 g Na2X含有Na+ 0.1 mol,则X的相对原子质量为________。
Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)用双线桥表示该反应电子转移的方向和数目_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,80g Br2含有的原子数为NA
B.标准状况下,22.4L CCl4含有的分子数为NA
C.1mol·L-1Fe2(SO4)3溶液中含SO42-的数目为3NA
D.4.6g Na露置在空气中充分反应,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com