
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
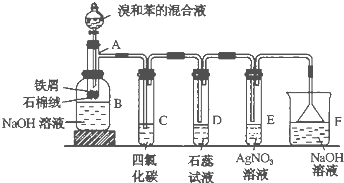
填写下列空白:
①试管A中的反应方程式为______。
②试管C中四氯化碳的作用是:______,反应开始后,观察到D试管中的现象为:___ 。
③在上述整套装置中,具有防倒吸的仪器有______(填字母)。
④反应完毕后,将B瓶中的液体取出,经过_____(填分离操作的名称)可获得粗溴苯,向粗溴苯中加入无水氯化钙,其目的是____。
⑤经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是______。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
【答案】![]() 除去溴化氢中混有的溴 D试管中石蕊试液变红色,并在导管口有白雾产生 DE F 分液 除水或干燥 C
除去溴化氢中混有的溴 D试管中石蕊试液变红色,并在导管口有白雾产生 DE F 分液 除水或干燥 C
【解析】
①根据苯和液溴发生取代反应生成溴苯和溴化氢解答;
②溴苯中的溴易挥发,非极性分子的溶质易溶于非极性分子的溶剂,据此分析苯的作用;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸能使石蕊试液变红色;
③因溴化氢极易溶解于水,导气管不插入溶液中、倒置漏斗或球形干燥管能防止溶液倒吸;
④反应后的混合液含有有机物和无机混合液,因相互不溶,静置后会出现分层现象,可选择分液漏斗进行分液操作,无水CaCl2有吸水性,加入到粗产品中可除去混有的少量水份;
⑤获得的粗溴苯中仍混合相互混的苯和少量溴,可根据各组分的沸点差异进行分离。
①在催化剂的作用下,苯环上的氢原子溴原子所取代,生成溴苯,同时有溴化氢生成,其反应方程式为:![]() ;
;
故答案为:![]() 。
。
②溴苯中的溴易挥发,溴和苯都是非极性分子,根据相似相溶原理知,溴易溶于苯,所以苯的作用是吸收溴蒸汽;该反应中有溴化氢生成,溴化氢溶于水得到氢溴酸,氢溴酸是酸性物质,能使石蕊试液变红色;所以观察D看到的现象是D试管中石蕊试液变红色,并在导管口有白雾产生;
故答案为:除去HBr中混有的溴蒸气;D试管中石蕊试液变红色,并在导管口有白雾产生。
③当两端压力发生压力变化时,液体会产生倒吸现象,DE装置中导气管不插入溶液中可以防止倒吸,倒置的漏斗下口很大,液体上升很小的高度就有很大的体积,上升的液体的本身的压力即可低偿压力的不均衡.因此由于上部还有空气隔离,液体不会倒吸入上端的细管道,所以具有防倒吸作用的仪器有DEF,故答案为:DEF。
④反应后的混合液静置后会出现分层现象,可选择分液漏斗进行分液操作,得到的粗溴苯中仍有少量水溶液,可加入无水CaCl2利用其有吸水性,达到吸水干燥的目的,故答案为:分液;除水或干燥。
⑤粗溴苯中仍含有苯、溴,由于三者互溶在一起,而且它们的沸点不同,所以可采用蒸馏的方法来分离,故答案为:C。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,2.24LCO2中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含原子总数为NA
C.在室温和常压下,72g36Cl2中含有36Cl原子的数目为2NA
D.18g重水D2O中所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机反应类型的认识中,错误的是
A. ![]() ;取代反应
;取代反应
B. CH2=CH2 + Br2![]() CH2Br-CH2Br;加成反应
CH2Br-CH2Br;加成反应
C. 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;取代反应
2CH3CHO+2H2O;取代反应
D. CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3+H2O;取代反应
CH3COOCH2CH3+H2O;取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为______。
(2)0.1mol烷烃E完全燃烧,消耗标准状况下的O211.2L,其分子式为______。
(3)用相对式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为______。
(4)立方烷![]() 其分子式为______,它的六氯代物有______种。
其分子式为______,它的六氯代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因_____________________ (多选题)
A.定容时液面低于刻度线
B.未冷却到室温就定容
C.定容时液面高于刻度线
D.量取浓硫酸时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是

A. 若甲为单质,乙为O2,且甲可以与NaOH溶液反应放出H2,则丙不一定是两性氧化物
B. 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊可能是氧化还原反应
C. 若甲为硫磺燃烧产物,丁为水,则戊的浓溶液不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:
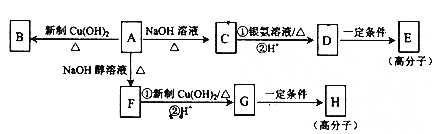
(1) A-F的反应类型是______________;G中含氧官能团的名称是____________。
(2)A-C的反应方程式是____________________。
(3)H的结构简式是____________________,E的结构简式是____________。
(4)有的同学认为B中可能没有氯原子,你的观点是________________(填“同意”或“不同意”)你的理由_______________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____________(写结构简式);只含有两个甲基的同分异构体有____________种。
①相对分子质量比C少54 ;②氧原子数与C相同 ; ③能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气,该反应的化学方程式为:![]() 用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
用双线桥法表示该反应过程中的电子转移情况______________________,该反应中氧化剂为____________,HCl的作用是______________________。
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的离子方程式是_________________________________。
(3)已知在碱性溶液中可发生如下反应![]() ,则
,则![]() 中R的化合价是________。
中R的化合价是________。
A.+3 B.+4 C.+5 D.+6
(4)填写下列空白:
①等物质的量的CO和CO2中:所含的分子数目之比为_______,相同条件下体积之比为_______,所含的原子总数目之比为_______。
②有下列物质:
a.硫酸 b.盐酸 c.氯气 d.硫酸钡 e.甲烷 f.铜 g.CH3COOH h.氯化氢 i.蔗糖 j.氨气 k.CO2 l.NaHCO3 m.Al(OH)3 n.NaOH溶液
其中属于非电解质的为_____________(填序号,下同。),属于电解质的为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com