
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
【答案】[Ar] 3d5 N>O>S sp2 分子晶体 正四面体形 10 CN- 或C22— 3∶1 12 ![]()
【解析】
(1)Fe原子核外有26个电子,Fe3+电子排布式为1s22s22p63s23p63d5,简化电子排布式为[Ar]3d5;
(2)氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;苯酚中碳原子的杂化轨道类型与苯分子中杂化轨道类型相同;
(3)FeCl3的熔沸点较低,说明FeCl3的晶体类型是分子晶体;SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体形;
(4)CO的结构式为C![]() O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键;等电子体是指具有相同价电子数目和原子数目的分子或离子;
O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键;等电子体是指具有相同价电子数目和原子数目的分子或离子;
(5)由晶胞结构可知铁微粒位于顶点和面心上,氮微粒位于体内;
(6)根据晶胞结构可知Fe2+为面心立方,与Fe2+紧邻的等距离的Fe2+有12个;用“均摊法”可得晶胞中含Fe2+:8×1/8+6×1/2=4个,含O2-:12×1/4+1=4个,晶体的化学式为FeO。
(1)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,简化电子排布式为[Ar]3d5,故答案为:[Ar]3d5;
(2)根据同周期同主族元素性质递变规律判断,同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S;苯酚中碳原子的杂化轨道类型与苯分子中杂化轨道类型相同,都为sp2杂化,故答案为:N>O>S;sp2;
(3)FeCl3的熔沸点较低,说明FeCl3的晶体类型是分子晶体;SO42-离子中含有4个σ键,没有孤电子对,所以其立体构型是正四面体形,故答案为:分子晶体;正四面体形;
(4)CO的结构式为C![]() O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键;1个Fe(CO)5分子中含10个σ键,1molFe(CO)5分子中含10molσ键;等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO互为等电子体的离子为CN-或C22—,故答案为:10;CN-或C22—;
O,三键中含1个σ键和2个π键,中心原子Fe与配体CO之间形成配位键,配位键也是σ键;1个Fe(CO)5分子中含10个σ键,1molFe(CO)5分子中含10molσ键;等电子体是指具有相同价电子数目和原子数目的分子或离子,与CO互为等电子体的离子为CN-或C22—,故答案为:10;CN-或C22—;
(5)由晶胞结构可知铁微粒位于顶点和面心上,氮微粒位于体内,用“均摊法”可得晶胞中含Fe个数为12×1/6+2×1/2+3=6个,N原子个数为2个,该晶体中铁、氮的微粒个数之比为6:2=3:1,故答案为:3:1;
(6)根据晶胞结构可知Fe2+为面心立方,与Fe2+紧邻的等距离的Fe2+有12个;用“均摊法”可得晶胞中含Fe2+:8×1/8+6×1/2=4个,含O2-:12×1/4+1=4个,晶体的化学式为FeO,1molFeO的质量为72g,1mol晶体的体积为72/ρcm3;晶胞的体积为72/ρcm3![]() NA×4=288/(ρNA)cm3,晶胞的边长为
NA×4=288/(ρNA)cm3,晶胞的边长为![]() cm,Fe2+与O2-最短核间距为
cm,Fe2+与O2-最短核间距为![]() cm=
cm=![]() cm=
cm=![]() 1010pm,故答案为:12;
1010pm,故答案为:12;![]() 。
。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),得出的相关数据如表所示:
2SO3(g),得出的相关数据如表所示:
时间/min | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
0 | 0.200 | 0.100 | 0 |
10 | 0.190 | 0.095 | 0.010 |
15 | 0.160 | 0.080 | 0.040 |
20 | 0.160 | 0.080 | 0.040 |
25 | 0.150 | 0.150 | 0.050 |
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.

(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为__________(用含m1、m2的代数式表示).
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________
A.KSCN溶液、氯水B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+.设计实验方案验证泡铜中是否含有Cu2O__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,22.4LCHCl3中含有的分子数为NA
B. 1L 0.1mol·L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA
C. 白磷结构如图所示,12.4g白磷中所包含的P—P共价键有0.6NA

D. 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)环境污染已成人类社会面临的重大威胁。下列名词与环境污染无关的是________(填:序号)。
①赤潮 ②温室效应 ③酸雨 ④光化学烟雾 ⑤水力发电 ⑥臭氧层空洞 ⑦潮汐 ⑧农药化肥的不当使用 ⑨地方性大脖子病 ⑩工业“三废”和生活污水的任意排放
(2)火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(NO2),已知热化学方程式:
N2(g)+2O2(g)==2NO2(g) △H=+67.7kJ/mol; N2H4(g)+O2(g)==N2(g)+2H2O(g) △H=-534kJ/mol。请写出气态肼与NO2气体反应生成氮气和水蒸气的热化学方程式___________________________。该反应应用于火箭推进,除能释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________________。
(3)乙烯(C2H4)结构简式为CH2=CH2,且知:C-H键、C=C键、O=O键、C=O键、O-H键的键能分别是:413kJ/mol、615kJ/mol、496kJ/mol、745kJ/mol、463kJ/mol,则表达乙烯(C2H4)气体“燃烧热”的热化学方程式:C2H4(g) +3O2(g) =2CO2(g) +2H2O(l)中,△H=-______kJ/mol。
如果有2.4NA个电子发生转移,所放出的热量值是____________kJ。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成N3-。两步反应的能量变化如图:

①第一步是______反应(选填“放热”或“吸热”),判断依据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去)。
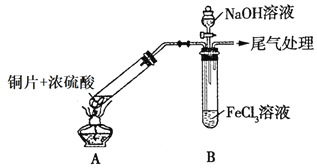
(1)图中盛放NaOH溶液的玻璃仪器名称是______。
(2)实验前,应先检查装置的______;实验开始后,A装置中试管内发生反应的化学方程式为______。实验中产生尾气可通入______(填写化学试剂)进行吸收处理。
(3)B试管中装有5mL1molL-1FeCl3溶液,往其中通入足量的SO2气体,B试管中的实验现象为______,写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水中的碘萃取出来的实验中,下列说法错误的是 ( )
A. 分液漏斗使用前要检查它是否漏水
B. 酒精比水更容易使碘溶解,酒精可以做萃取剂
C. 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后,静置,分液
D. 分液时,下层液体应从下口流出,上层液体应从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科理论和实践的发展遵循其内在规律,在相近的知识体系间有着密切关联性。
I.分析下列有关电化学装置图
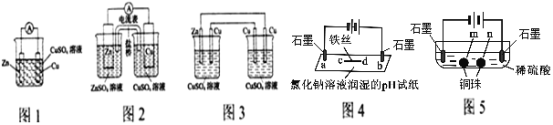
(1)图2装置原电池相比图1装置原电池可获得较长时间的稳定的电流,原因是_________________________________。
(2)将图2装置中CuSO4溶液为电解质溶液,盐桥用铜导线代替后变为图3装置,该装置从左到右电极名称依次是_________________________________。
(3)图4装置中d处电极反应式为:______________________。
(4)根据相同原理,图5装置中两个石墨电极附近有气泡产生,___________处能析出铜。
Ⅱ·温室效应使地球变暧成为人类社会急需解决的重要环境问题。研究表明,在 Cu/ZnO催化剂存在下,H2可还原CO2,发生如下两个平行反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
相同投料和压强下,经过相同反应时间测得如下实验数据:

注:M--Cu/ZnO纳米棒;N--Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ ·mol-1
②H2O(l)=H2O(g) △H3=+44.0 kJ·mol-1,请回答(不考虑温度对△H的影响):
(1)有利于生成甲醇反应的平衡常数表达式K=______________。
(2)提高CO2转化为CH3OH平衡转化率的措施有___________。
A.使用催化剂M B.使用催化剂N
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质①H2O,②CuO,③CuSO4,④NaOH,⑤氨水,其中属于氧化物的是__________,(请填序号,下同)属于盐的是__________,属于混合物的是__________,属于电解质的是__________。
(2)在氮的化合物中,红棕色、有刺激性气味的有毒气体是__________,(填写化学式)
(3)根据反应 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
(4)纯净的H2在Cl2中燃烧发出__________色火焰。
(5)金属钠切开后,光亮的金属断面__________,说明常温下钠能够跟__________反应,生成__________;钠投入水中,钠__________水面上,并四处游动,发出响声,这说明__________,熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液__________。
(6)配平:①_____HNO3(稀)+____Cu=_____Cu(NO3)2+____H2O+ NO↑
②___H2SO4(浓)+_____C![]() _____CO2↑+_____SO2↑+_____H20
_____CO2↑+_____SO2↑+_____H20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com