
����Ŀ����ѧѧ�����ۺ�ʵ���ķ�չ��ѭ�����ڹ��ɣ��������֪ʶ��ϵ���������й����ԡ�
I.���������йص绯ѧװ��ͼ
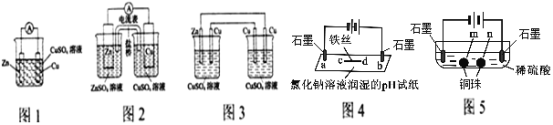
��1��ͼ2װ��ԭ������ͼ1װ��ԭ��ؿɻ�ýϳ�ʱ����ȶ��ĵ�����ԭ����_________________________________��
��2����ͼ2װ����CuSO4��ҺΪ�������Һ��������ͭ���ߴ�����Ϊͼ3װ�ã���װ�ô����ҵ缫����������_________________________________��
��3��ͼ4װ����d���缫��ӦʽΪ��______________________��
��4��������ͬԭ����ͼ5װ��������ʯī�缫���������ݲ�����___________��������ͭ��
������ЧӦʹ������ӳ�Ϊ������ἱ��������Ҫ�������⡣�о��������� Cu/ZnO���������£�H2�ɻ�ԭCO2��������������ƽ�з�Ӧ��
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H1=��53.7kJ ��mol��1
CH3OH(g)+H2O(g) ��H1=��53.7kJ ��mol��1
CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H2
CO(g)+H2O(g) ��H2
��ͬͶ�Ϻ�ѹǿ����������ͬ��Ӧʱ��������ʵ��������

ע��M--Cu/ZnO���װ���N--Cu/ZnO����Ƭ���״�ѡ���ԣ�ת����CO2�����ɼ״��İٷֱ�
��֪����CO��H2�ı�ȼ���ȷֱ�Ϊ��283.0 kJ��mol��1�ͣ�285.8 kJ ��mol��1
��H2O(l)=H2O(g) ��H3=+44.0 kJ��mol-1����ش�(�������¶ȶ���H��Ӱ��)��
��1�����������ɼ״���Ӧ��ƽ�ⳣ������ʽK=______________��
��2�����CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ��___________��
A.ʹ�ô���M B.ʹ�ô���N
C.���ͷ�Ӧ�¶� D.Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ��
E.����CO2��H2�ij�ʼͶ�ϱ�
��3������ʵ�����ݱ���������ͬ�¶��²�ͬ�Ĵ�����CO2ת����CH3OH��ѡ������������Ӱ�죬��ԭ����____________________________________________��
���𰸡�������Ӧ�ͻ�ԭ��Ӧ�ֿ��ڲ�ͬ������� ���������������������� 2H����2e��=H2����2H2O��2e��=H2����2OH�� m��n�����ʯī�缫 c(CH3OH)��c(H2O)/[c(CO2)��c3(H2)] CD ��ʱ��Ӧδ�ﵽƽ�⣬��ͬ�Ĵ����Է�Ӧ�Ĵ�������ͬ
��������
I.��1������ͼ1��ͼ2װ�ã�ͼ2װ�ÿɻ�ýϳ�ʱ���ȶ�������ԭ����������Ӧ�ͻ�ԭ��Ӧ�ֿ��ڲ�ͬ������У�
��2��ͼ3�����װ��Ϊԭ��أ��Ҳ�װ��Ϊ���أ�Zn��ͭ���ã������ZnΪ������CuΪ�������Ҳ�װ�ô������ҷֱ�Ϊ������������
��3��װ���Ҷ�ʯīΪ��������d��Ϊ���������ݵ��ԭ����d����ӦʽΪ��2H����2e��=H2����2H2O��2e��=H2����2OH����
��4�����ݵ��ԭ�������ʯīΪ�������Ҳ�ʯīΪ������ͼ5��Ӧ���������أ�����������ͭ����m��n�����ʯī�缫��
II.��1������ƽ�ⳣ���Ķ��壬���ɼ״���Ӧ��ƽ�ⳣ��K=c(CH3OH)��c(H2O)/[c(CO2)��c3(H2)]��
��2��A�������Ի�ѧƽ���ƶ���Ӱ�죬��A���������⣻
B������Aѡ���������B���������⣻
C���÷�ӦΪ���ȷ�Ӧ�����ͷ�Ӧ�¶ȣ�ƽ��������Ӧ�����ƶ���CO2ת��Ϊ�״���ƽ��ת��������C�������⣻
D��Ͷ�ϱȲ��䣬���ӷ�Ӧ���Ũ�ȣ��൱������ѹǿ��ƽ��������Ӧ�����ƶ���CO2ת��Ϊ�״���ƽ��ת��������D�������⣻
E������CO2��H2�ij�ʼͶ�ϱȣ�������CO2��������Ȼƽ��������Ӧ�����ƶ�����CO2ת��Ϊ�״���ƽ��ת���ʽ��ͣ���E���������⣻
��3�������Ի�ѧƽ���ƶ���Ӱ�죬���ݱ������ݣ�˵����Ӧδ�ﵽƽ�⣬���ԭ��ʱ��Ӧδ�ﵽƽ�⣬��ͬ�Ĵ����Է�Ӧ�Ĵ�������ͬ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L�����ܱ������г���X(g)��Y(g)��������ӦX(g)+Y(g)![]() M(g)+N(g)������ʵ���������±���
M(g)+N(g)������ʵ���������±���
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(X) | n(Y) | n(M) | ||
�� | 700 | 0.10 | 0.10 | 0.09 |
�� | 800 | 0.20 | 0.20 | 0.10 |
�� | 800 | 0.20 | 0. 30 | a |
�� | 900 | 0.10 | 0.15 | b |
����˵���������
A. ʵ����У���5minʱ���n(M) =0.05mol����0��5minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N) =0.01 mol/( L��min)
B. ʵ����У��÷�Ӧ��ƽ�ⳣ��K= 1.0
C. ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ����У��ﵽƽ��ʱ��b>0.06
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������й㷺Ӧ�á�
(1)��̬Fe3+�ĵ����Ų�ʽΪ_________________��
(2)ʵ������KSCN��Һ������(![]() )����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
)����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
(3)FeCl3���۵�Ϊ306�棬�е�Ϊ315�档FeCl3�ľ���������________��FeSO4������������SO42-�����幹����__________��
(4)�ʻ���[Fe(CO)5]���������������Ϳ������ȡ�1 mol Fe(CO)5�����к�________mol�Ҽ�����CO��Ϊ�ȵ������������__________(�ѧʽ��дһ��)��
(5)����������ľ���ṹʾ��ͼ��ͼ1��ʾ���þ�������������������֮��Ϊ_____��

(6)������������ľ�����ͼ2��ʾ����֪����������������ܶ�Ϊ��g��cm-3��NA���������ӵ�������ֵ���ڸþ����У���Fe3+�����ҵȾ����Fe2+��ĿΪ_____��Fe2+��O2-����̺˼��Ϊ___________pm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ�������������˵������ȷ����( )
A.���Ͻ�����ܶ�С����ǿ�ȼ��ϺõĿ����ԣ��������Ʒɻ��Ǽܵȡ�
B.������Ȼ����������̬�ͻ���̬������ʽ
C.���ڱ���������ܵ�����������˽������ڿ����������õĿ���ʴ�ԡ�
D.��������һ�ָ�Ӳ�ȡ����۷е�Ļ�����챦ʯ������ʯ����Ҫ�ɷ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ������Һ�У��ܴ���������������ǣ�������
A. Ag+��K+��NO3����Cl�� B. Ca2+��Fe3+��Cl����NO3��
C. Mg2+��Na+��Cl����SO42�� D. H+��NH4+��Na+��CH3COO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����Ԫ�������ڱ��е����λ�����±����������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʣ���������ͬ����Ԫ�أ������ж���ȷ����(����)
![]()
A.�����ԣ��ף��ң���
B.ԭ�Ӱ뾶������������
C.�������ԭ�Ӻ�����������3
D.�ҵĵ����ڿ�����ȼ������ֻ�����Ӽ��Ļ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʳ���¶���ڿ����л���ʣ��ұ��ʹ������漰������ԭ��Ӧ����
��Na ��NaOH ��FeSO4 ����ˮ
A.�٢�B.�ڢ�C.�٢ۢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ϩ���Ϻ���Ȼ������ʹ��ˮ��ɫ
B. 2-��ϩ����������ԭ���п�����ͬһƽ��
C. ��ϩ�ͻ�����Ķ��ȴ������Ŀ��ͬ�������������칹��
D. ����������������Ƶ��Ҵ���Һ���Ȳ���������ͨ����ˮ�У���Һ��ɫ��˵������ϩ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com