
【题目】下列说法正确的是
A. 聚乙烯塑料和天然橡胶均不能使溴水褪色
B. 2-丁烯分子中所有原子有可能在同一平面
C. 丙烯和环己烷的二氯代物的数目相同(不考虑立体异构)
D. 将溴乙烷和氢氧化钠的乙醇溶液共热产生的气体通入溴水中,溶液褪色,说明有乙烯生成
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化学学科理论和实践的发展遵循其内在规律,在相近的知识体系间有着密切关联性。
I.分析下列有关电化学装置图
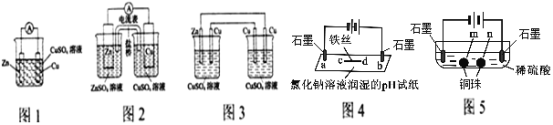
(1)图2装置原电池相比图1装置原电池可获得较长时间的稳定的电流,原因是_________________________________。
(2)将图2装置中CuSO4溶液为电解质溶液,盐桥用铜导线代替后变为图3装置,该装置从左到右电极名称依次是_________________________________。
(3)图4装置中d处电极反应式为:______________________。
(4)根据相同原理,图5装置中两个石墨电极附近有气泡产生,___________处能析出铜。
Ⅱ·温室效应使地球变暧成为人类社会急需解决的重要环境问题。研究表明,在 Cu/ZnO催化剂存在下,H2可还原CO2,发生如下两个平行反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
相同投料和压强下,经过相同反应时间测得如下实验数据:

注:M--Cu/ZnO纳米棒;N--Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ ·mol-1
②H2O(l)=H2O(g) △H3=+44.0 kJ·mol-1,请回答(不考虑温度对△H的影响):
(1)有利于生成甲醇反应的平衡常数表达式K=______________。
(2)提高CO2转化为CH3OH平衡转化率的措施有___________。
A.使用催化剂M B.使用催化剂N
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质①H2O,②CuO,③CuSO4,④NaOH,⑤氨水,其中属于氧化物的是__________,(请填序号,下同)属于盐的是__________,属于混合物的是__________,属于电解质的是__________。
(2)在氮的化合物中,红棕色、有刺激性气味的有毒气体是__________,(填写化学式)
(3)根据反应 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
(4)纯净的H2在Cl2中燃烧发出__________色火焰。
(5)金属钠切开后,光亮的金属断面__________,说明常温下钠能够跟__________反应,生成__________;钠投入水中,钠__________水面上,并四处游动,发出响声,这说明__________,熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液__________。
(6)配平:①_____HNO3(稀)+____Cu=_____Cu(NO3)2+____H2O+ NO↑
②___H2SO4(浓)+_____C![]() _____CO2↑+_____SO2↑+_____H20
_____CO2↑+_____SO2↑+_____H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为____________,H2(g)的平衡转化率为___________,在此温度下,该反应的平衡常数K=____________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是_________(填入下列条件的序号,下同),乙条件可能是__________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是___________(用含一个a、b、c的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素 R 的最高价氧化物的水化物分子式是 HnRO2n﹣2,则在气态氢化物中 R 元素的化合价是( )
A.3n﹣10B.12﹣3nC.3n﹣4D.3n﹣12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法不正确的是
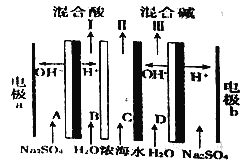
A. 电极b连接电源的负极 B. Ⅱ口排出的是淡水
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. C为阴离子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com