
【题目】下列物质长期露置于空气中会变质,且变质过程中涉及氧化还原反应的是
①Na ②NaOH ③FeSO4 ④氯水
A.①②B.②③C.①③④D.②③④
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,22.4LCHCl3中含有的分子数为NA
B. 1L 0.1mol·L-1的NaHS溶液中HS-和S2-离子数之和为0.1NA
C. 白磷结构如图所示,12.4g白磷中所包含的P—P共价键有0.6NA

D. 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科理论和实践的发展遵循其内在规律,在相近的知识体系间有着密切关联性。
I.分析下列有关电化学装置图
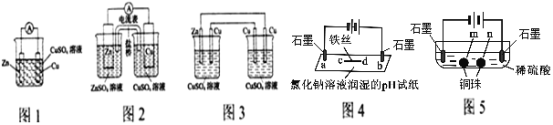
(1)图2装置原电池相比图1装置原电池可获得较长时间的稳定的电流,原因是_________________________________。
(2)将图2装置中CuSO4溶液为电解质溶液,盐桥用铜导线代替后变为图3装置,该装置从左到右电极名称依次是_________________________________。
(3)图4装置中d处电极反应式为:______________________。
(4)根据相同原理,图5装置中两个石墨电极附近有气泡产生,___________处能析出铜。
Ⅱ·温室效应使地球变暧成为人类社会急需解决的重要环境问题。研究表明,在 Cu/ZnO催化剂存在下,H2可还原CO2,发生如下两个平行反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
相同投料和压强下,经过相同反应时间测得如下实验数据:

注:M--Cu/ZnO纳米棒;N--Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ ·mol-1
②H2O(l)=H2O(g) △H3=+44.0 kJ·mol-1,请回答(不考虑温度对△H的影响):
(1)有利于生成甲醇反应的平衡常数表达式K=______________。
(2)提高CO2转化为CH3OH平衡转化率的措施有___________。
A.使用催化剂M B.使用催化剂N
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,0.1mol镁和0.1mol铝分别和足量的稀盐酸起反应后产生的氢气的质量
A. 镁产生的多 B. 铝产生的多 C. 镁和铝产生的一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生探究0.25 mol·L-1 Al2(SO4)3溶液与0.5 mol·L-1 Na2CO3溶液的反应,实验如下。下列分析错误的是
实验1 |
|
实验2 |
|
A. 实验1中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b中含有CO![]()
C. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
D. 实验1、2中,白色沉淀成分不同可能与混合后溶液的pH有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质①H2O,②CuO,③CuSO4,④NaOH,⑤氨水,其中属于氧化物的是__________,(请填序号,下同)属于盐的是__________,属于混合物的是__________,属于电解质的是__________。
(2)在氮的化合物中,红棕色、有刺激性气味的有毒气体是__________,(填写化学式)
(3)根据反应 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
(4)纯净的H2在Cl2中燃烧发出__________色火焰。
(5)金属钠切开后,光亮的金属断面__________,说明常温下钠能够跟__________反应,生成__________;钠投入水中,钠__________水面上,并四处游动,发出响声,这说明__________,熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液__________。
(6)配平:①_____HNO3(稀)+____Cu=_____Cu(NO3)2+____H2O+ NO↑
②___H2SO4(浓)+_____C![]() _____CO2↑+_____SO2↑+_____H20
_____CO2↑+_____SO2↑+_____H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com