
【题目】在相同条件下,0.1mol镁和0.1mol铝分别和足量的稀盐酸起反应后产生的氢气的质量
A. 镁产生的多 B. 铝产生的多 C. 镁和铝产生的一样多 D. 无法比较
科目:高中化学 来源: 题型:
【题目】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。减少CO2排放是一项重要课题。
(1)以CO2为原料制取碳(C)的太阳能工艺如图所示。

①过程1中每生成1molFeO转移电子数为_______________。
②过程2中发生反应的化学方程式为___________________________。
(2)碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料,用甲醇、CO、CO2在常压、70~120℃和催化剂条件下合成DMC。
已知:①CO的燃烧热为△H =﹣283.0 kJ·mol-1
②H2O(l)= H2O(g) △H = + 44.0 kJ·mol-1
③2CH3OH(g)+CO2(g)![]() CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
CH3OCOOCH3 (g)+ H2O(g) △H =﹣15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
CH3OCOOCH3 (g)+ H2O(l) △H =_______________。
(3)在密闭容器中按n(CH3OH):n(CO2)=2:1投料直接合成DMC,一定条件下,平衡时CO2的转化率如图所示,则:

①v(A)、v(B)、v(C)由快到慢的顺序为____________________;
②K(A)、K(B)、K(C)由大到小的顺序为___________________;
③下列能说明在此条件下反应达到平衡状态的是__________。
A.2v正(CH3OH)= v逆(CO2) B.CH3OH与CO2的物质的量之比保持不变
C.容器内气体的密度保持不变 D.各组分的物质的量分数保持不变
(4)CO2经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
反应Ⅰ:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应II:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
为分析催化剂对反应的选择性,在1 L密闭容器中充入1 molCO2和2 mol H2,测得有关物质的物质的量随温度变化如图所示。

①该催化剂在较低温度时主要选择________(填“反应Ⅰ”或“反应II”)。520℃时,反应II的平衡常数K=___________(只列算式不计算)。
②用惰性电极电解强酸性的二氧化碳水溶液可得到乙烯,其原理如图所示。b电极上的电极反应式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属铝及氧化铝说法不正确的是( )
A.铝合金具有密度小、高强度及较好的可塑性,可用于制飞机骨架等。
B.铝在自然界中有游离态和化合态两种形式
C.由于表面存在致密的氧化铝,因此金属铝在空气中有良好的抗腐蚀性。
D.氧化铝是一种高硬度、高熔沸点的化合物,红宝石、蓝宝石的主要成分是氧化铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
![]()
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差3
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基乙酸(H2NCH2COOH)是蛋白质的水解产物之一,1 mol 的氨基乙酸中含有( )
A.2 mol氧气分子
B.12 mol氢原子
C.6.02×1023个H+
D.6.02×1023个氨基乙酸分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质长期露置于空气中会变质,且变质过程中涉及氧化还原反应的是
①Na ②NaOH ③FeSO4 ④氯水
A.①②B.②③C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
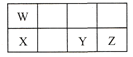
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:

(1)表中用于半导体材料的元素在周期表中的位置________________________。
(2)写出短周期金属性最强的元素的离子结构示意图:_____。
(3)③、④、⑤三元素离子半径从大到小的顺序是________________填离子符号)。
(4)②、③、④的气态氢化物,稳定性最强的是_______________填化学式)。
(5)设计实验证明⑤、⑥的金属性强弱__________________________。
(6)在一定条件下,利用置换反应可实现物质之间的转化(仅限于①-⑨中涉及的元素)
①同族元素之间,则反应可能为_____________。
②不同族元素之间,则反应可能为_____________(以上反应各写一条化学方程式即可)。
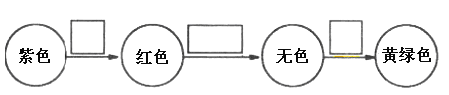
(7)将⑨的单质通入石蕊溶液中发生的颜色变化如下图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。_____________、_____________、_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com