
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Ag+、K+、NO3﹣、Cl﹣ B. Ca2+、Fe3+、Cl﹣、NO3﹣
C. Mg2+、Na+、Cl﹣、SO42﹣ D. H+、NH4+、Na+、CH3COO﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是

A. 图中五点Kw间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量酸的方法
C. 若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D. 若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)环境污染已成人类社会面临的重大威胁。下列名词与环境污染无关的是________(填:序号)。
①赤潮 ②温室效应 ③酸雨 ④光化学烟雾 ⑤水力发电 ⑥臭氧层空洞 ⑦潮汐 ⑧农药化肥的不当使用 ⑨地方性大脖子病 ⑩工业“三废”和生活污水的任意排放
(2)火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(NO2),已知热化学方程式:
N2(g)+2O2(g)==2NO2(g) △H=+67.7kJ/mol; N2H4(g)+O2(g)==N2(g)+2H2O(g) △H=-534kJ/mol。请写出气态肼与NO2气体反应生成氮气和水蒸气的热化学方程式___________________________。该反应应用于火箭推进,除能释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________________。
(3)乙烯(C2H4)结构简式为CH2=CH2,且知:C-H键、C=C键、O=O键、C=O键、O-H键的键能分别是:413kJ/mol、615kJ/mol、496kJ/mol、745kJ/mol、463kJ/mol,则表达乙烯(C2H4)气体“燃烧热”的热化学方程式:C2H4(g) +3O2(g) =2CO2(g) +2H2O(l)中,△H=-______kJ/mol。
如果有2.4NA个电子发生转移,所放出的热量值是____________kJ。
(4)在微生物作用的条件下,NH4+经过两步反应被氧化成N3-。两步反应的能量变化如图:

①第一步是______反应(选填“放热”或“吸热”),判断依据是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水中的碘萃取出来的实验中,下列说法错误的是 ( )
A. 分液漏斗使用前要检查它是否漏水
B. 酒精比水更容易使碘溶解,酒精可以做萃取剂
C. 注入碘水和萃取剂,倒转分液漏斗反复用力振荡后,静置,分液
D. 分液时,下层液体应从下口流出,上层液体应从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属元素在不同的化合物中化合价均相同
B.所有合金都只含有金属元素
C.可利用铝热反应冶炼单质镁
D.电解熔融氯化钠可以制得金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学科理论和实践的发展遵循其内在规律,在相近的知识体系间有着密切关联性。
I.分析下列有关电化学装置图
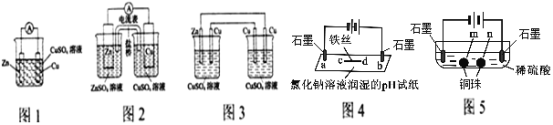
(1)图2装置原电池相比图1装置原电池可获得较长时间的稳定的电流,原因是_________________________________。
(2)将图2装置中CuSO4溶液为电解质溶液,盐桥用铜导线代替后变为图3装置,该装置从左到右电极名称依次是_________________________________。
(3)图4装置中d处电极反应式为:______________________。
(4)根据相同原理,图5装置中两个石墨电极附近有气泡产生,___________处能析出铜。
Ⅱ·温室效应使地球变暧成为人类社会急需解决的重要环境问题。研究表明,在 Cu/ZnO催化剂存在下,H2可还原CO2,发生如下两个平行反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CH3OH(g)+H2O(g) △H1=-53.7kJ ·mol-1
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
相同投料和压强下,经过相同反应时间测得如下实验数据:

注:M--Cu/ZnO纳米棒;N--Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0 kJ·mol-1和-285.8 kJ ·mol-1
②H2O(l)=H2O(g) △H3=+44.0 kJ·mol-1,请回答(不考虑温度对△H的影响):
(1)有利于生成甲醇反应的平衡常数表达式K=______________。
(2)提高CO2转化为CH3OH平衡转化率的措施有___________。
A.使用催化剂M B.使用催化剂N
C.降低反应温度 D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +
+![]() =
=![]() 表示的是
表示的是
A.NH4Cl+NaOH![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
B.Mg(OH)2+2HCl=MgCl2+2H2O
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为____________,H2(g)的平衡转化率为___________,在此温度下,该反应的平衡常数K=____________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是_________(填入下列条件的序号,下同),乙条件可能是__________。
① 恒容条件下,升高温度
② 恒容条件下,降低温度
③ 恒温条件下,缩小反应容器体积
④ 恒温条件下,扩大反应容器体积
⑤ 恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是___________(用含一个a、b、c的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com