
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,2.24LCO2中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含原子总数为NA
C.在室温和常压下,72g36Cl2中含有36Cl原子的数目为2NA
D.18g重水D2O中所含质子数为10NA
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2+ +2OH- ![]() CH3COONH4 +3NH3+2Ag↓+H2O
CH3COONH4 +3NH3+2Ag↓+H2O
B. 苯酚钠溶液中通入少量CO2:CO2 +H2O+2C6H5O-→2C6H5OH+CO32-
C. 氯乙烷中滴入AgNO3溶液检验其中氯元素:Cl-+Ag+=AgCl↓
D. 乙酸滴入氢氧化铜悬浊液中:2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②KMnO4+ HCl(浓)= KCl+ MnCl2+ Cl2↑+ H2O(未配平)
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目(写在答题卡上)_________________________
(2)配平②___KMnO4+___HCl(浓)=___KCl+___MnCl2+___Cl2↑+___H2O 写出②的离子方程式________________________________;(友情提示:MnCl2易溶于水)②中氧化剂与还原剂分子数之比为_____________。
(3)反应②中氯化氢表现出的性质是________________________。
(4)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡,它们都可看作化学平衡。请根据所学知识回答下列问题:
(1)AlCl3溶液呈______性(填“酸”“中”“碱”)原因是_________________________(用离子方程式表示);若把AlCl3溶液蒸干,灼烧,最后主要得到固体产物是________;若将AlCl3溶液和NaHCO3溶液混合,该反应的离子方程式为__________________________________________。
(2)将1L0.2 mol·L-1HA溶液与1L0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则:
①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同)。
②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。
(3)常温下,若NaOH溶液中c(OH—)与NH4Cl溶液中c(H+)相同,现将NaOH溶液和NH4Cl溶液分别稀释10倍,稀释后NaOH溶液和NH4CI溶液的pH分别用pH1和pH2表示。则pH1 +pH2________(填“>”“<”或“=”)14。
(4)pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是非常有用的材料,以下是四种金属的相关性质。
金属 | 熔点(℃) | 密度(g/cm3) | 相对强度 (1表示很弱) | 相对硬度 (1表示很软) | 每吨价格 (元) |
铝 | 660 | 2.7 | 11 | 2.8 | 11400 |
铜 | 1085 | 8.9 | 33 | 3.0 | 38000 |
铁 | 1538 | 7.9 | 20 | 4.5 | 4000 |
钛 | 1668 | 4.5 | 40 | 6.0 | 160000 |
完成下列填空:
(1)铝用作电线是利用了铝的_________性;铁用作炊具是利用了铁的_________性。
(2)工业上常以Cu为原料制备CuSO4,“绿色化学”要求从经济、技术和环保来设计可行的化学反应,生产应尽量减少对环境的副作用。下列反应符合“绿色化学”的是(_______)
A.Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2O
B.2Cu + O2![]() 2CuO,CuO + H2SO4→CuSO4 +H2O
2CuO,CuO + H2SO4→CuSO4 +H2O
(3)常温下由于浓硫酸能使铁___________,因此浓硫酸可用铁槽车运输。
(4)钛是制造飞机的材料之一。根据表中数据,解释为何用钛来制造飞机。______________
(5)钢是主要含有铁的合金。汽车车身可以用铝或钢制造。已知铁在潮湿的空气中会迅速腐蚀,而铝不会。请解释铝耐腐蚀的原因。_______________________________________
(6)根据表中数据,描述用铝来取钢制造汽车车身的一项优点和一项缺点。
优点:_____________________________________________________________________
缺点:_____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
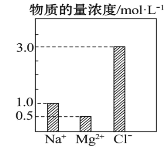
A.NaCl的物质的量为0.1mol
B.溶质MgCl2的质量为4.75g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1L,稀释后溶液中的Na+物质的量的浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液中有关浓度关系不正确的是( )
A. 浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-)
B. 0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C. 常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L
D. NH4+浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含碳酸钠杂质的氯化钠样品10克,与足量的盐酸反应,生成的气体在标准状况下体积为224mL,求:
(1)生成的气体是______________,物质的量为____________。
(2)该样品中含氯化钠的质量分数?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。
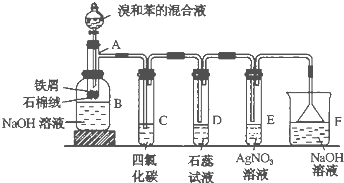
填写下列空白:
①试管A中的反应方程式为______。
②试管C中四氯化碳的作用是:______,反应开始后,观察到D试管中的现象为:___ 。
③在上述整套装置中,具有防倒吸的仪器有______(填字母)。
④反应完毕后,将B瓶中的液体取出,经过_____(填分离操作的名称)可获得粗溴苯,向粗溴苯中加入无水氯化钙,其目的是____。
⑤经以上分离操作后,要进一步提纯粗溴苯,下列操作中必须的是______。
A. 重结晶 B. 过滤 C. 蒸馏 D. 萃取
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com