
【题目】现有含碳酸钠杂质的氯化钠样品10克,与足量的盐酸反应,生成的气体在标准状况下体积为224mL,求:
(1)生成的气体是______________,物质的量为____________。
(2)该样品中含氯化钠的质量分数?(写出计算过程)
【答案】⑴ CO2、0.01 mol (2分) ⑵ 89.4%(5分)
【解析】
碳酸钠与足量的盐酸反应,生成氯化钠、水和二氧化碳,n(CO2)=0.01mol,根据Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑反应关系可求出m (Na2CO3) ,ω(NaCl)。
碳酸钠与足量的盐酸反应,生成氯化钠、水和二氧化碳,n(CO2)=0.01mol,反应如下:
Na2CO3+ 2HCl == 2NaCl + H2O + CO2↑
106g 1mol
m (Na2CO3) 0.01mol
m (Na2CO3) =1.06g;ω(NaCl) =![]() ×100%= 89.4%;
×100%= 89.4%;
故答案是:生成的气体是CO2,物质的量为0.01mol,该样品中含氯化钠的质量分数89.4%。


科目:高中化学 来源: 题型:
【题目】(1)已知Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.6×10-39。常温下,某酸性CuCl2溶液中含有少量的FeCl3,为了得到纯净的CuCl2·2H2O晶体,应加入___________(填氧化物的化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗涤液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
①用稀盐酸溶解碳酸钙的离子方程式是_____________________________。
②已知:25 ℃时有关物质的溶度积
物质 | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8×10-9 | 9.1×10-6 | 1.8×10-11 | 6.8×10-6 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________。(用溶解平衡表达式和必要的文字叙述加以说明);在步骤Ⅰ浸泡过程中还会发生反应MgCO3(s)+2OH-(aq)![]() Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
Mg(OH)2(s)+CO32-(aq),该反应的平衡常数K=________(保留两位有效数字)。
③步骤Ⅲ中,加入Na2SO3溶液的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.标准状况下,2.24LCO2中所含分子数为0.1NA
B.常温常压下,14gCO和N2混合气所含原子总数为NA
C.在室温和常压下,72g36Cl2中含有36Cl原子的数目为2NA
D.18g重水D2O中所含质子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CO和2 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生 反应:CO(g)+2H2(g)=CH3OH(g),ΔH=a kJ/mol,如图。下列分析中正确的是

A.250°C时,010minH2 反应速率为 0.015 mol,/(L.min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容积体积,CO体积分数增大
D.a<0,平衡常数K:T0C时大于2500C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、丁是中学化学常见的物质,一定条件下可发生如下转化:下列相关离子方程式或化学方程式错误的是( )

A. ①可能为CH4+Cl2![]() CH3Cl+HClB. ①可能为Fe+2Fe3+=3Fe2+
CH3Cl+HClB. ①可能为Fe+2Fe3+=3Fe2+
C. ②可能为2NO+O2=2NO2D. ②可能为CO32-+H2O+CO2=2HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量______g;
(2)有以下仪器:①烧杯②药匙 ③250mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平⑦量筒.配制时,必须使用的玻璃仪器______(填序号),还缺少的仪器是______;
(3)使用容量瓶前必须进行的一步操作是______;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为______(填序号);
①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移
(5)配制过程中,下列操作会引起结果偏高的是______(填序号);
①未洗涤烧杯、玻璃棒;
②称量NaOH的时间太长;
③定容时俯视刻度;
④容量瓶不干燥,含有少量蒸馏水;
⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)某同学用浓硫酸配制的稀硫酸浓度偏低,则可能的原因是______(填序号)。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁后将洗涤液弃去
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容、摇匀后发现溶液的凹液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机反应类型的认识中,错误的是
A. ![]() ;取代反应
;取代反应
B. CH2=CH2 + Br2![]() CH2Br-CH2Br;加成反应
CH2Br-CH2Br;加成反应
C. 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;取代反应
2CH3CHO+2H2O;取代反应
D. CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3+H2O;取代反应
CH3COOCH2CH3+H2O;取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:
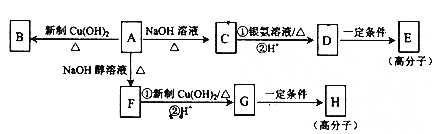
(1) A-F的反应类型是______________;G中含氧官能团的名称是____________。
(2)A-C的反应方程式是____________________。
(3)H的结构简式是____________________,E的结构简式是____________。
(4)有的同学认为B中可能没有氯原子,你的观点是________________(填“同意”或“不同意”)你的理由_______________。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____________(写结构简式);只含有两个甲基的同分异构体有____________种。
①相对分子质量比C少54 ;②氧原子数与C相同 ; ③能发生水解反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com