
����Ŀ��ʵ�����ù����ռ�����0.1mol/L��NaOH��Һ480mL����ش�
(1)������ҪNaOH��������______g��
(2)���������������ձ���ҩ�� ��250mL����ƿ��500mL����ƿ�ݲ�������������ƽ����Ͳ������ʱ������ʹ�õIJ�������______������ţ�����ȱ�ٵ�������______��
(3)ʹ������ƿǰ������е�һ��������______��
(4)������Һʱ���ڼ��㡢�������ܽ⡢��ȴ�������¼������裬����ȷ�IJ���˳��Ϊ______������ţ���
����ҡ�ȣ���ϴ�ӣ��۶��ݣ��ܵߵ�ҡ�ȣ���ת��
(5)���ƹ����У����в�����������ƫ�ߵ���______������ţ���
��δϴ���ձ�����������
�ڳ���NaOH��ʱ��̫����
�۶���ʱ���ӿ̶ȣ�
������ƿ�����������������ˮ��
��NaOH��Һδ��ȴ�����¾�ת�Ƶ�����ƿ��
(6)ijͬѧ��Ũ�������Ƶ�ϡ����Ũ��ƫ�ͣ�����ܵ�ԭ����______(�����)��
������Ͳ��ȡŨ����ʱ�����ӿ̶���
������ƿ������ˮϴ�Ӻ�δ������
��ϴ���ձ��ڱں�ϴ��Һ��ȥ
��ת����Һʱ��������������Һ����
�ݶ���ʱ����������ƿ�̶���
���ݡ�ҡ�Ⱥ�����Һ�İ�Һ����ڿ̶���
���𰸡�2.0 �٢ܢ� ��ͷ�ι� ����Ƿ�©ˮ �ݢڢ٢ۢ� �ۢ� �ۢ�
��������
(1)����m=cVM�������ʵ�������
(2)���ݲ�������ѡȡʵ��������
(3)����ƿʹ��ǰ�ü���Ƿ�©ˮ��
(4)��������һ�����ʵ���Ũ����Һһ�㲽����
(5)�����������������ʵ����ʵ�������Һ�����Ӱ�죬����c=![]() ������������
������������
(6)����c=![]() ������������
������������
(1)����0.1mol/L��NaOH��Һ480mL��Ӧѡ��500mL����ƿ����Ҫ���ʵ�����m(NaOH)=0.1mol/L��0.5L��40g/mol=2.0g��
(2)���Ʋ����м��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ�(������Ͳ��ȡˮ)����ȴ��ת�Ƶ�500mL����ƿ�У����ò�����������ϴ���ձ���������2��3�Σ���ϴ��Һ��������ƿ����ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ��ʱ���ʹ�õIJ������������ձ� ��500mL����ƿ �ݲ��������ʺ�������Ǣ٢ܢݣ�����Ҫ�IJ������������ǣ���ͷ�ιܡ�
(3)����ƿʹ��ǰ�ü���Ƿ�©ˮ��
(4)����һ�����ʵ���Ũ����Һ�IJ����м��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����������ȷ��˳��Ϊ���ݢڢ٢ۢܣ�
(5)��δϴ���ձ������������������ʵ����ʵ���ƫС��ʹ��Һ��Ũ��ƫ�ͣ��ٲ��������⣻
�ڳ���NaOH��ʱ��̫�������³�ȡ���������Ƶ����ʵ���ƫ�ͣ�ʹ��ҺŨ��ƫ�ͣ��ڲ��������⣻
�۶���ʱ���ӿ̶ȣ�������Һ���ƫС��ʹ��ҺŨ��ƫ�۷������⣻
������ƿ�����������������ˮ�������ʵ����ʵ�������Һ�������Ӱ�죬��ҺŨ�Ȳ��䣬�ܲ��������⣻
��NaOH��Һδ��ȴ�����¾�ת�Ƶ�����ƿ����ȴ����Һ�����С��������ҺŨ��ƫ�ݷ������⣻
�ʺ���ѡ���Ǣۢݣ�
(6)������Ͳ��ȡŨ����ʱ�����ӿ̶��ߣ�������ȡ��Ũ����ƫ�࣬���ʵ����ʵ���ƫ��ʹ��Һ��Ũ��ƫ�ߣ��ٲ��������⣻
������ƿ������ˮϴ�Ӻ�δ���������Һ��Ũ�Ȳ������Ӱ�죬�ڲ��������⣻
��ϴ���ձ��ڱں�ϴ��Һ��ȥ���������ʵ����ʵ���ƫС��ʹ��Һ��Ũ��ƫ�ͣ��۷������⣻
��ת����Һʱ��������������Һ�������������ʵ����ʵ���ƫС��ʹ��Һ��Ũ��ƫ�ͣ��ܷ������⣻
�ݶ���ʱ����������ƿ�̶��ߣ�������Һ�����ƫС����Һ��Ũ��ƫ�ߣ��ݲ��������⣻
���ݡ�ҡ�Ⱥ�����Һ�İ�Һ����ڿ̶��ߣ��ò�������������������Һ��Ũ����Ӱ�죬���������⣻
�ʺ���ѡ���Ǣۢܡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ʾʵ�飬����ͽ��۾���ȷ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ũ�Ⱦ�Ϊ0.lmol/LNaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp(AgCl)>Ksp(AgI) |
B | �����£��ⶨ�����ʵ���Ũ�ȵ� Na2CO3��Na2SO3��Һ��pHֵ | ǰ�ߵ�pHֵ�Ⱥ��ߵĴ� | �ǽ����ԣ�S>C |
C | ��ij��Һ�м��������ữ���Ȼ�����Һ | ��Һ���а�ɫ�������� | ����Һ�к���SO42- |
D | ��FeCl3��KSCN�����Һ�У���������KC1���� | ��Һ��ɫ��dz | FeCl3+3KSCN |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1L��NaCl��MgCl2��BaCl2��ɵĻ����Һ�У���������Ũ�ȴ�С��ͼ��ʾ�����жԸ���Һ�ɷ�˵������ȷ���ǣ� ��
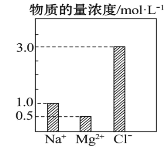
A.NaCl�����ʵ���Ϊ0.1mol
B.����MgCl2������Ϊ4.75g
C.�û��Һ��BaCl2�����ʵ���Ϊ0.1mol
D.���û��Һ��ˮϡ�������Ϊ1L��ϡ�ͺ���Һ�е�Na+���ʵ�����Ũ��Ϊ0.1mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�2.24L Cl2����ˮ��NaOH��Һ��ת�Ƶĵ�������Ϊ0.1NA
B. ���³�ѹ�£�18g H2O���е���ԭ������ΪNA
C. 2.3g����������������ȼ�գ�ת�Ƶĵ�����Ϊ0.1NA
D. 0.1mol CH3OH������C-H������ĿΪ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к�̼�������ʵ��Ȼ�����Ʒ10�ˣ������������ᷴӦ�����ɵ������ڱ�״�������Ϊ224mL����
��1�����ɵ�������______________�����ʵ���Ϊ____________��
��2������Ʒ�к��Ȼ��Ƶ�������������д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KIO3��һ����Ҫ�������������Ϊʳ���еIJ�����������Ʊ��������¡�
��1�����������������ѧ��Ӧ����ʽΪ��6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12��ÿ����3mol KH(IO3)2����Ӧ��ת�Ƶĵ�����Ϊ______����Ӧ����Һ�м�______��Һ�õ�KIO3��
��2��һ���ɺ����ˮ��ȡ����صĹ�����ͼ��

�ٽ��С�����1��ʱ����ͬʱ��CuI��������ϴ�ӡ���ϴ��Һ�п�ͨ���μ�______����Һ���������Ƿ���ϴ�Ӹɾ���
�ڡ���FeI2��ʱ��������Ӧ�Ļ�ѧ����ʽΪ______��
����KIO3��KHSO3�����Ի����Һ�м�������KI���������͵��ۣ���ͣ�ؽ��裬��Ӧ����Ϊ����һ��IO3-+5I-+6H+=3I2+3H2O�ڶ�����Ӧ�����ӷ���ʽΪ______��
����Ӧ���е�1.5minʱ����ҺͻȻ��Ϊ��ɫ����֮�ֺܿ���ʧ�����______����Ӧ���ʿ졣
�ܸı䷴Ӧ�¶ȣ��ظ�����ʵ�飬�õ��¶ȣ�T������Һ��������ʱ�䣨t���Ĺ�ϵ��ͼ��ʾ������50�����Һ�����ٱ�����������ͼ����������¶ȵ���50��ʱ����Һ��������ʱ���뷴Ӧ�¶ȵĹ�ϵ��_________��

��3��ɽ��ʡ���µ�ʳ���ε⺬����ÿǧ���κ���25���ˣ�������ΧΪ18��33mgkg-1�����ⶨʳ�������е�Ԫ�غ����IJ������£���ȡ4.000g����ʳ�μ�����ƿ�У����μ���������ˮ���Թ���KI��ϡ�����ַ�Ӧ���ټ���12.00mL6.000��10-4molL-1Na2S2O3��Һ�������ɵĵ�ǡ����ȫ��Ӧ���йط�Ӧԭ��Ϊ��
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O��I2+2S2O32-=2I-+S4O62-�������ʳ�������е�Ԫ�صĺ���______mgkg-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飨����һ�ֲ�����ˮ���ܶȱ�ˮС��Һ�壩��
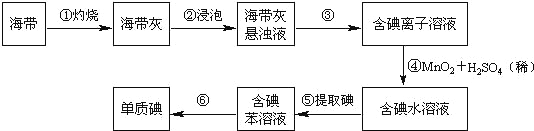
����д���пհף�
��1����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������_______��������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A���ձ� B������ C�������� D�������� E���ƾ��� F��������
��2������۵�ʵ�����������_______�������Ŀ���ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ����ò����ʵ�����������_______��
��3�����������ȡ����Һ��ijѧ��ѡ���ñ�����ȡ���������_______���ڷ�Һ�����У�Ӧ�����Ȼ���ã����ֲ��________�����ţ��������ԡ�
A��ֱ�ӽ����ⱽ��Һ�ӷ�Һ©���Ͽڵ���
B��ֱ�ӽ����ⱽ��Һ�ӷ�Һ©���¿ڷų�
C���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ⱽ��Һ���¿ڷų�
D���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ⱽ��Һ���Ͽڵ���
��4�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ�����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д�����з�Ӧ�����ӷ���ʽ��
��1��NaOH��HCl��Ӧ��________________
��2��Zn��ϡH2SO4��Ӧ��________________
��3��Na2SO4��BaCl2��Ӧ��________________
��4��CaCO3��ϡHCl��Ӧ��________________
��5��CuSO4��Fe��Ӧ��________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڸ����������ܷ����������ж���ȷ����������Ӧ�����ӷ���ʽҲ��ȷ����
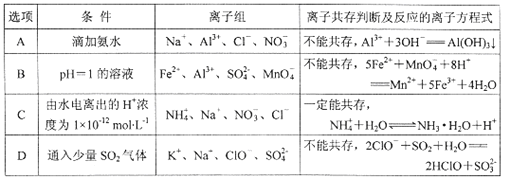
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com