
����Ŀ���������з�Ӧ��
��2H2O+Cl2+SO2��H2SO4+2HCl
��KMnO4+ HCl(Ũ)�� KCl+ MnCl2+ Cl2��+ H2O��δ��ƽ��
�������������Ӧ�ش�
��1���õ����ű�����е���ת�Ƶķ������Ŀ��д�ڴ���ϣ�_________________________
��2����ƽ��___KMnO4+___HCl(Ũ)��___KCl+___MnCl2+___Cl2��+___H2O д���ڵ����ӷ���ʽ________________________________����������ʾ��MnCl2������ˮ�������������뻹ԭ��������֮��Ϊ_____________��
��3����Ӧ�����Ȼ�����ֳ���������________________________��
��4��Cl2��SO2��KMnO4����������ǿ������˳��Ϊ__________________________��
���𰸡�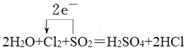 2 16 2 2 5 8 2MnO4��+16H++10Cl��=2Mn2++5Cl2��+8H2O 1��5 ���ԡ���ԭ�� KMnO4 >Cl2>SO2
2 16 2 2 5 8 2MnO4��+16H++10Cl��=2Mn2++5Cl2��+8H2O 1��5 ���ԡ���ԭ�� KMnO4 >Cl2>SO2
��������
��1�����ݻ�ԭ��ʧ���ӣ�ת�Ƹ����������е����ű�ע��ע�����������ԭ��Ӧ���ɷ�������ת�Ƶ�������
��2�����ݵ����غ㡢ԭ���غ������ƽ������������ԭ��Ӧ���ɷ����������뻹ԭ���ķ�����֮�ȣ�
��3����Ӧ�����Ȼ�������Ԫ�ز��ֻ��ϼ����ߣ����ֳ������������ԡ���ԭ�ԡ�
��4�����������ԣ���������������������з�����
��1���÷�Ӧ��SԪ�ػ��ϼ���+4�۱�Ϊ+6�ۡ�ClԪ�ػ��ϼ���0�۱�Ϊ-1�ۣ��õ����ű�����е���ת�Ƶķ������Ŀ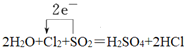 ��
��
��2���÷�Ӧ��MnԪ�ػ��ϼ���+7�۱�Ϊ+2�ۡ�����ClԪ�ػ��ϼ���-1�۱�Ϊ0�ۡ�����ClԪ�ػ��ϼ۲��䣬��ת�Ƶ�������Ϊ10����KMnO4��ϵ��Ϊ2������ϵ��Ϊ5�����ԭ���غ���ƽ����ʽΪ��2KMnO4+16HCl=2MnCl2+5Cl2��+2KCl+8H2O���ڵ����ӷ���ʽ 2MnO4��+16H++10Cl��=2Mn2++5Cl2��+8H2O��������������KMnO4���뻹ԭ����HCl��������֮��Ϊ2:10=1:5��
��3����Ӧ�����Ȼ�����ֳ������������ԡ���ԭ�ԣ�
��4��������ԭ��Ӧ����������������ǿ����������ɢ������ԣ�Cl2>SO2���ɢ������ԣ�KMnO4 >Cl2��Cl2��SO2��KMnO4����������ǿ������˳��Ϊ KMnO4 >Cl2>SO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������л���������������������ţ��ɶ�����з��������Ԥ�⡣
�������л����������ڴ������ʵ���____(����ĸ)��
a��CH3CH2OH b��CH3CHO c��![]()
�������л��������м���Ũ��ˮ�����ɰ�ɫ��������____(����ĸ)��
a��CH2��CH2�� ������ b���� ������ c��![]()
�������л��������ܷ���ˮ�ⷴӦ����____(����ĸ)��
a�����ᡡ�� b����֬���� c��������
��2���л���W��![]() ���㷺�����������ֲ��Ĺ����С�
���㷺�����������ֲ��Ĺ����С�
��W���������������ŵ�����Ϊ____��____��
��W�����д���ͬһƽ���̼ԭ�������____����
��1mol W�����������____mol H2�����ӳɷ�Ӧ��
��3�����ǻ������������� ���dz��õ�ʳƷ����������ͨ�����·����ϳɣ�
���dz��õ�ʳƷ����������ͨ�����·����ϳɣ�
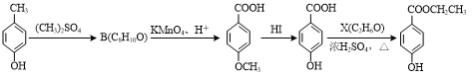
A���������������� ������������ C �������� D���������� E
��C��D�ķ�Ӧ����Ϊ____��
��B�Ľṹ��ʽΪ____��
��D��̼�����Ʒ�Ӧ�������л���Ľṹ��ʽΪ____��
��D��E��Ӧ�Ļ�ѧ����ʽΪ____��
��д��ͬʱ��������������C��һ��ͬ���칹��Ľṹ��ʽ��____��
���ܺ�FeCl3��Һ������ɫ��Ӧ��
���ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ��
�����к���4�ֲ�ͬ��ѧ��������ԭ�ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Dz��ֿ�����Դ������(��Ҫ������������������)�ͻ�ͭ��(��Ҫ�ɷ�CuFeS2)�����ü���Ʒ�������̣��й�˵������ȷ���ǣ� ��
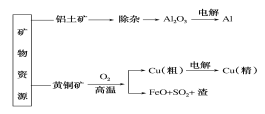
A. ���ӹ�������Ԫ�صĴ�����ʽ�ı仯�������£�Al2O3��AlO2-��Al(OH)3��Al2O3
B. Al��Cu(��)���ڵ��۵��������
C. ��ͭ���ƹ����з�Ӧ2CuFeS2��O2![]() Cu2S��2FeS��SO2��ÿת��1.2mol���ӣ�����0.2mol������
Cu2S��2FeS��SO2��ÿת��1.2mol���ӣ�����0.2mol������
D. ����ⷨ�ֱ�������ͭ�Ĺ�����ת�Ƶ�������ȣ������ϻ�õ�����ͭ�����ʵ���֮��Ϊ3:2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪Ksp[Cu(OH)2]��2.2��10��20��Ksp[Fe(OH)3]��2.6��10��39�������£�ij����CuCl2��Һ�к���������FeCl3��Ϊ�˵õ�������CuCl2��2H2O���壬Ӧ����___________(��������Ļ�ѧʽ)��������Һ��pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��________�����˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2��2H2O���塣
(2)ij̼�ظֹ�¯��ˮ������Ҫ�ɷ���̼��ơ�����ơ�������þ�����⡢��������ȡ�ˮ���輰ʱ��ϴ��ȥ����ϴ�������£�
��.����NaOH��Na2CO3���Һ�����ȣ�������Сʱ��
��.�ų�ϴ�ӷ�Һ����ˮ��ϴ��¯������ϡ���������NaF��Һ�����ݣ�
��.��ϴ��Һ�м���Na2SO3��Һ��
��.��ϴ��꣬��NaNO2��Һ�ۻ���¯��
����ϡ�����ܽ�̼��Ƶ����ӷ���ʽ��_____________________________��
����֪��25 ��ʱ�й����ʵ��ܶȻ�
���� | CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
Ksp | 2.8��10��9 | 9.1��10��6 | 1.8��10��11 | 6.8��10��6 |
�������ݣ���ϻ�ѧƽ��ԭ��������ϴCaSO4�Ĺ���________________�������ܽ�ƽ�����ʽ�ͱ�Ҫ��������������˵�������ڲ������ݹ����л��ᷢ����ӦMgCO3(s)��2OH��(aq)![]() Mg(OH)2(s)��CO32-(aq)���÷�Ӧ��ƽ�ⳣ��K��________(������λ��Ч����)��
Mg(OH)2(s)��CO32-(aq)���÷�Ӧ��ƽ�ⳣ��K��________(������λ��Ч����)��
�۲�����У�����Na2SO3��Һ��Ŀ����_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cl2����ijЩ�����л���ʱ�����ɸ�����HCl���������з�Ӧ��ʵ���ȵ�ѭ�����ã�4HCl(g)��O2(g) ![]() 2Cl2(g)��2H2O(g)����H����115.6 kJ��mol��1�����º��ݵ��ܱ������У�����һ�����ķ�Ӧ���������Ӧ���ܳ��˵���÷�Ӧ�ﵽ��ѧƽ��״̬����(���� )
2Cl2(g)��2H2O(g)����H����115.6 kJ��mol��1�����º��ݵ��ܱ������У�����һ�����ķ�Ӧ���������Ӧ���ܳ��˵���÷�Ӧ�ﵽ��ѧƽ��״̬����(���� )
A. ���������ܶȲ��ٸı�
B. �Ȼ����ת���ʲ��ٸı�
C. �Ͽ�4 mol H��Cl����ͬʱ����4 mol H��O��
D. n(HCl)��n(O2)��n(Cl2)��n(H2O)��4��1��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ�������������ܱ������з�����Ӧ��X(g)+3Y(g)![]() 2Z(g)��������ڲ�ͬʱ�̵�Ũ�����±�������˵����ȷ����
2Z(g)��������ڲ�ͬʱ�̵�Ũ�����±�������˵����ȷ����
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
2 minĩŨ��/mol��L-1 | 0.08 | a | b |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
A. ƽ��ʱ��X��ת����Ϊ20%
B. t ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ40
C. ǰ2 min�ڣ���Y�ı仯����ʾ��ƽ����Ӧ����v(Y)="0.03" mol��L-1��min-1
D. ����ƽ������ϵѹǿ��v������v����С��ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��Fe2O3��Al2O3��Ʒ�ܽ��ڹ�����200mL pH=1��������Һ�У�Ȼ�������м���NaOH ��ҺʹFe3+��Al3+�պ���ȫ��������ȥNaOH ��Һ100 mL,��NaOH ��Һ��Ũ��Ϊ
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵������ȷ���ǣ� ��
A.��״���£�2.24LCO2������������Ϊ0.1NA
B.���³�ѹ�£�14gCO��N2���������ԭ������ΪNA
C.�����ºͳ�ѹ�£�72g36Cl2�к���36Clԭ�ӵ���ĿΪ2NA
D.18g��ˮD2O������������Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������й㷺Ӧ�á�
(1)��̬Fe3+�ĵ����Ų�ʽΪ_________________��
(2)ʵ������KSCN��Һ������(![]() )����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
)����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ_______��
(3)FeCl3���۵�Ϊ306�棬�е�Ϊ315�档FeCl3�ľ���������________��FeSO4������������SO42-�����幹����__________��
(4)�ʻ���[Fe(CO)5]���������������Ϳ������ȡ�1 mol Fe(CO)5�����к�________mol�Ҽ�����CO��Ϊ�ȵ������������__________(�ѧʽ��дһ��)��
(5)����������ľ���ṹʾ��ͼ��ͼ1��ʾ���þ�������������������֮��Ϊ_____��

(6)������������ľ�����ͼ2��ʾ����֪����������������ܶ�Ϊ��g��cm-3��NA���������ӵ�������ֵ���ڸþ����У���Fe3+�����ҵȾ����Fe2+��ĿΪ_____��Fe2+��O2-����̺˼��Ϊ___________pm��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com