
����Ŀ��t ��ʱ�������������ܱ������з�����Ӧ��X(g)+3Y(g)![]() 2Z(g)��������ڲ�ͬʱ�̵�Ũ�����±�������˵����ȷ����
2Z(g)��������ڲ�ͬʱ�̵�Ũ�����±�������˵����ȷ����
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
2 minĩŨ��/mol��L-1 | 0.08 | a | b |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
A. ƽ��ʱ��X��ת����Ϊ20%
B. t ��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ40
C. ǰ2 min�ڣ���Y�ı仯����ʾ��ƽ����Ӧ����v(Y)="0.03" mol��L-1��min-1
D. ����ƽ������ϵѹǿ��v������v����С��ƽ��������Ӧ�����ƶ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£�1.7g������ռ�����Ϊ__L�������״����__L���⺬����ͬ��Ŀ����ԭ�ӡ�
��2��ͬ��ͬѹ�£�SO2�뺤�����ܶ�֮��Ϊ___����������ͬ����������������֮��Ϊ___���������ͬ���������������֮��Ϊ___��
��3���ڱ�״���£���4gH2����11.2LO2����1molH2O�У�����������������(����ţ���ͬ)___����ԭ����������___������������___�������С����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ù�ҵ����ʯ����������SiO2��Al2O3��Fe2O3�����ʣ���ȡCaCl2��6H2O��������������̣�
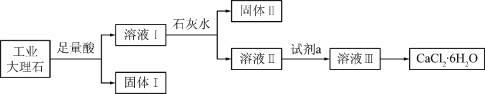
����˵������ȷ����
A. ����I���SiO2������II���Fe(OH)3
B. ʹ��ʯ��ˮʱ��Ҫ����pH����ֹ����II��Al(OH)3ת��ΪAlO2-
C. �Լ�aѡ�����ᣬ����ҺIII�õ�CaCl2��6H2O��Ʒ�Ĺ����У������������ֹ��ֽ�
D. ���ı�ʵ�鷽��������ҺI��ֱ�ӼӰ�ˮ��������ȫ����ȥ����������Һ������Ũ������ȴ�ᾧҲ�ɵõ�����CaCl2��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ʾʵ�飬����ͽ��۾���ȷ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ũ�Ⱦ�Ϊ0.lmol/LNaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp(AgCl)>Ksp(AgI) |
B | �����£��ⶨ�����ʵ���Ũ�ȵ� Na2CO3��Na2SO3��Һ��pHֵ | ǰ�ߵ�pHֵ�Ⱥ��ߵĴ� | �ǽ����ԣ�S>C |
C | ��ij��Һ�м��������ữ���Ȼ�����Һ | ��Һ���а�ɫ�������� | ����Һ�к���SO42- |
D | ��FeCl3��KSCN�����Һ�У���������KC1���� | ��Һ��ɫ��dz | FeCl3+3KSCN |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������з�Ӧ��
��2H2O+Cl2+SO2��H2SO4+2HCl
��KMnO4+ HCl(Ũ)�� KCl+ MnCl2+ Cl2��+ H2O��δ��ƽ��
�������������Ӧ�ش�
��1���õ����ű�����е���ת�Ƶķ������Ŀ��д�ڴ���ϣ�_________________________
��2����ƽ��___KMnO4+___HCl(Ũ)��___KCl+___MnCl2+___Cl2��+___H2O д���ڵ����ӷ���ʽ________________________________����������ʾ��MnCl2������ˮ�������������뻹ԭ��������֮��Ϊ_____________��
��3����Ӧ�����Ȼ�����ֳ���������________________________��
��4��Cl2��SO2��KMnO4����������ǿ������˳��Ϊ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£�ˮ��Һ��c(H��)��c(OH��)�Ĺ�ϵ��ͼ��ʾ�������й�˵������ȷ����(����)
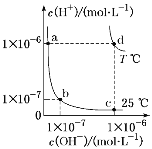
A. d���Ӧ��ʳ��ˮpH��6��������
B. ��a���Ӧ��CH3COOH��Һ�еμ�NaOH��Һ��b�㣬��ʱc(Na��)��c(CH3COO��)
C. a���Ӧ��ϡ������c���Ӧ��CH3COONa��Һ��ˮ�ĵ���̶���ͬ
D. �¶�ΪT ��ʱ��0.05 mol��L��1Ba(OH)2��Һ��pH��11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ��ͳ����ܽ�ƽ�⣬���Ƕ��ɿ�����ѧƽ�⡣�������ѧ֪ʶ�ش��������⣺
(1)AlCl3��Һ��______��(��ᡱ���С����)ԭ����_________________________(�����ӷ���ʽ��ʾ)������AlCl3��Һ���ɣ����գ������Ҫ�õ����������________������AlCl3��Һ��NaHCO3��Һ��ϣ��÷�Ӧ�����ӷ���ʽΪ__________________________________________��
(2)��1L0.2 mol��L��1HA��Һ��1L0.1 mol��L��1NaOH��Һ��������(��Ϻ���Һ����仯���Բ���)����û����Һ��c(Na��)>c(A��)����
�ٻ����Һ�У�c(A��)________c(HA)(�>����<����������ͬ)��
�ڻ����Һ�У�c(HA)��c(A��)________0.1 mol��L��1��
(3)�����£���NaOH��Һ��c(OH��)��NH4Cl��Һ��c(H+)��ͬ���ֽ�NaOH��Һ��NH4Cl��Һ�ֱ�ϡ��10����ϡ�ͺ�NaOH��Һ��NH4CI��Һ��pH�ֱ���pH1��pH2��ʾ����pH1 +pH2________(�>����<������)14��
(4)pH��ͬ�Ģ�CH3COONa����NaHCO3����NaClO������Һ��c(Na��)��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1L��NaCl��MgCl2��BaCl2��ɵĻ����Һ�У���������Ũ�ȴ�С��ͼ��ʾ�����жԸ���Һ�ɷ�˵������ȷ���ǣ� ��
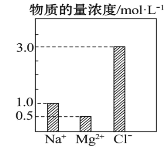
A.NaCl�����ʵ���Ϊ0.1mol
B.����MgCl2������Ϊ4.75g
C.�û��Һ��BaCl2�����ʵ���Ϊ0.1mol
D.���û��Һ��ˮϡ�������Ϊ1L��ϡ�ͺ���Һ�е�Na+���ʵ�����Ũ��Ϊ0.1mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ⡣Ϊ�˴Ӻ�������ȡ�⣬ij�о���ѧϰС����Ʋ�����������ʵ�飨����һ�ֲ�����ˮ���ܶȱ�ˮС��Һ�壩��
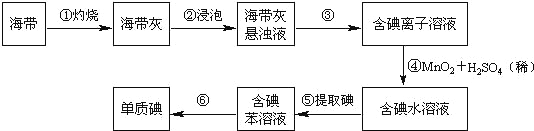
����д���пհף�
��1����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������_______��������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A���ձ� B������ C�������� D�������� E���ƾ��� F��������
��2������۵�ʵ�����������_______�������Ŀ���ǴӺ��ⱽ��Һ�з�������ʵ�ͻ��ձ����ò����ʵ�����������_______��
��3�����������ȡ����Һ��ijѧ��ѡ���ñ�����ȡ���������_______���ڷ�Һ�����У�Ӧ�����Ȼ���ã����ֲ��________�����ţ��������ԡ�
A��ֱ�ӽ����ⱽ��Һ�ӷ�Һ©���Ͽڵ���
B��ֱ�ӽ����ⱽ��Һ�ӷ�Һ©���¿ڷų�
C���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ⱽ��Һ���¿ڷų�
D���Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ����ⱽ��Һ���Ͽڵ���
��4�������һ�ּ�����ȡ����ˮ��Һ���Ƿ��е��ʵ�ļ�����_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com