
【题目】(1)在标准状况下,1.7g氨气所占的体积为__L,它与标准状况下__L硫化氢含有相同数目的氢原子。
(2)同温同压下,SO2与氦气的密度之比为___;若质量相同,则两种气体的体积之比为___;若体积相同,两种气体的质量之比为___。
(3)在标准状况下,①4gH2;②11.2LO2;③1molH2O中,所含分子数最多的是(填序号,下同)___,含原子数最多的是___,质量最大的是___,体积最小的是___。
【答案】2.24 3.36 16∶1 1∶16 16∶1 ① ① ③ ③
【解析】
(1)根据![]() 计算得NH3的物质的量
计算得NH3的物质的量![]() ,标准状况下Vm=22.4L/mol,故氨气体积V=0.1×22.4L=2.24L。0.1molNH3含有0.3molH原子,与0.15molH2S中含有的H原子数目相同,0.15molH2S的气体体积为V=0.15×22.4L=3.36L;
,标准状况下Vm=22.4L/mol,故氨气体积V=0.1×22.4L=2.24L。0.1molNH3含有0.3molH原子,与0.15molH2S中含有的H原子数目相同,0.15molH2S的气体体积为V=0.15×22.4L=3.36L;
故答案为2.24; 3.36;
(2)由阿伏伽德罗定律得![]() ,可得
,可得![]() ,带入密度之比为
,带入密度之比为![]() 中,可得密度之比等于摩尔质量之比,SO2与氦气的密度之比为64:4=16:1,若两气体质量相同,则由
中,可得密度之比等于摩尔质量之比,SO2与氦气的密度之比为64:4=16:1,若两气体质量相同,则由![]() 可得体积之比等于物质的量之比,V SO2:VHe=
可得体积之比等于物质的量之比,V SO2:VHe= ![]() :
: ![]() =1:16。若两气体体积相等,则由
=1:16。若两气体体积相等,则由![]() 可得两物质的物质的量相同,由m=nM可得质量之比等于摩尔质量之比,m1:m2=64:4=16:1;
可得两物质的物质的量相同,由m=nM可得质量之比等于摩尔质量之比,m1:m2=64:4=16:1;
故答案为16∶11∶16;16∶1;
(3)①氢气的物质的量为![]() = 2mol,其分子数为2NA,原子数为4NA,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
= 2mol,其分子数为2NA,原子数为4NA,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
②氧气的物质的量为![]() =0.5mol,其分子数为0.5NA,原子数为NA,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
=0.5mol,其分子数为0.5NA,原子数为NA,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
③水的物质的量为1mol,其分子数为NA,原子数为3NA,质量为1mol×18g/mol=18g,标准状况下水为液体,其体积在三者中最小;
显然分子数最多的是①,原子数最多的是①,质量最大的是③,体积最小的是③;
故答案为①;①;③;③。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。

完成下列填空(填元素符号或化学式):
(1)元素B在元素周期表中的位置是第____周期第_____族,A、B、C三种元素原子半径从大到小的顺序是_________________;
(2)D简单离子的结构示意图为_____________,D、E中金属性较强的元素是________。D单质在空气中燃烧可生成淡黄色粉末X(D2O2),X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。
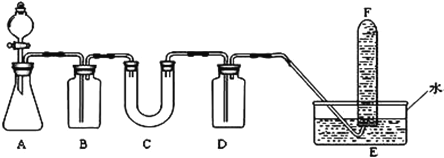
(3)装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是除去_____________;
(4)装置C中X与CO2反应的化学方程式是_____________________,装置D盛放NaOH溶液的作用是除去____________;
(5)为检验试管F收集的气体,进行____________操作,出现_________现象,即证明X可作供氧剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲配制6.0mol/L的H2SO4 1000 mL,实验室有三种不同浓度的硫酸:
①480mL 0.5mol/L 的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据有机化合物分子中所含官能团,可对其进行分类和性质预测。
①下列有机化合物属于醇类物质的是____(填字母)。
a.CH3CH2OH b.CH3CHO c.![]()
②下列有机化合物中加入浓溴水能生成白色沉淀的是____(填字母)。
a.CH2=CH2 b.苯 c.![]()
③下列有机化合物能发生水解反应的是____(填字母)。
a.乙酸 b.油脂 c.葡萄糖
(2)有机物W(![]() )广泛存在于肉桂类植物的果肉中。
)广泛存在于肉桂类植物的果肉中。
①W分子中所含官能团的名称为____和____。
②W分子中处于同一平面的碳原子最多有____个。
③1mol W分子最多能与____mol H2发生加成反应。
(3)对羟基苯甲酸乙酯( )是常用的食品防腐剂,可通过以下方法合成:
)是常用的食品防腐剂,可通过以下方法合成:
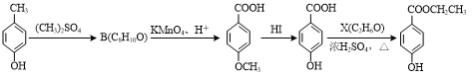
A C D E
①C→D的反应类型为____。
②B的结构简式为____。
③D与碳酸氢钠反应后所得有机物的结构简式为____。
④D→E反应的化学方程式为____。
⑤写出同时满足下列条件的C的一种同分异构体的结构简式:____。
Ⅰ.能和FeCl3溶液发生显色反应;
Ⅱ.能发生银镜反应,不能发生水解反应;
Ⅲ.分子中含有4种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数用NA表示,气体摩尔体积用Vm表示,物质的质量用m表示,请回答下列问题:
(1)n=![]() =
=![]() =
=![]() ,①②③处分别补充为___、___、___。
,①②③处分别补充为___、___、___。
(2)一个铜原子的质量为m’g,铜的相对原子质量为M’,则阿伏加德罗常数NA=___mol-1。(列出表达式,下同)
(3)常温下20滴水约为1mL,水的密度为1g·mL-1,每滴水中约含a个水分子,则阿伏加德罗常数NA=___mol-1。
(4)bgH2中含N个氢分子,则阿伏加德罗常数NA=___mol-1。
(5)在标准状况下,VLO2中含有N个氧原子,则阿伏加德罗常数NA=___mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验制备乙酸乙酯(如图1):
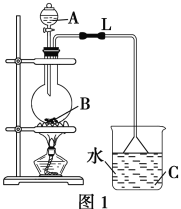
(1)实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是______________________。
(2)烧瓶B中加几块碎瓷片,其作用是__________。长导管L的作用是________________。
(3)图1方案有明显缺陷,请提出改进建议:_____________________________________。经改进后,实验现象是____________________________________________________。简述分离乙酸乙酯的操作方法:________________,需要用到的下列仪器有________(填代号)。
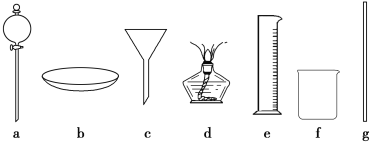
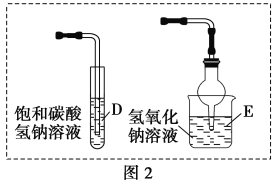
(4)①能否用图2的D装置替代图1的C装置?________(填“能”或“否”),理由是__________________________;
②能否用图2的E装置替代图1的C装置?________(填“能”或“否”),理由是___________________。
(5)实验中,若浓硫酸量过多,会导致后果是______________________________________(答两点即可)。经实验证明,可以用硫酸氢钠固体替代浓硫酸完成本实验,硫酸氢钠不溶于有机物,其优点是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的能源,通过石油分馏可得到重油,以重油为原料,可合成X:CH3COOCH=CH2。其中A是最简单的烯烃,B能发生银镜反应,D的相对分子质量比A小2。请回答下列有关问题:
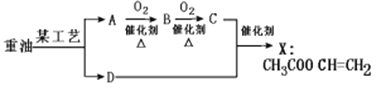
(1)A中的官能团名称是___________________
(2)B→C的化学方程式_____________________________
(3)已知C与D发生加成反应生成X,其化学方程式为________________________
(4)下列说法正确的是_____
A.此处的“某工艺”指的是分馏 B.B在一定条件下能与氢气发生加成反应
C.X不溶于水,能使酸性高锰酸钾溶液褪色 D.可用溴的四氯化碳溶液鉴别A和D
(5)F是X的同分异构体,1molF能与4molAg(NH3)2OH反应,写出F可能的结构简式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
D. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com