
����Ŀ��ij�о���ѧϰС�����ʵ���Ʊ���������(��ͼ1)��
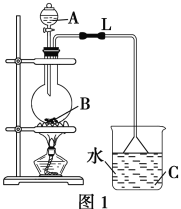
��1��ʵ������У��þƾ��ƻ������ȣ�������������Ŀ����______________________��
��2����ƿB�мӼ������Ƭ����������__________��������L��������________________��
��3��ͼ1����������ȱ�ݣ�������Ľ����飺_____________________________________�����Ľ���ʵ��������____________________________________________________�������������������IJ���������________________����Ҫ�õ�������������________(�����)��
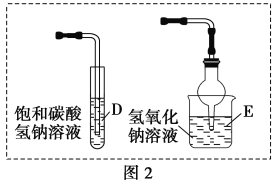
��4�����ܷ���ͼ2��Dװ�����ͼ1��Cװ�ã�________(����������������)��������__________________________��
���ܷ���ͼ2��Eװ�����ͼ1��Cװ�ã�________(����������������)��������___________________��
��5��ʵ���У���Ũ���������࣬�ᵼ�º����______________________________________(�����㼴��)����ʵ��֤�����������������ƹ������Ũ������ɱ�ʵ�飬�������Ʋ������л�����ŵ���____________________________________________________��
���𰸡�����������Ҵ��ӷ���������ʵ�ת���� ������ �����浼�� C����Һ���ɱ���̼������Һ C�ձ���Һ��ֲ㡢�ϲ�Һ����й���ζ���ҳ���״ ��C�ձ���Һ�������ò���������ע���Һ©������á��ֲ㣬��Һ©�����������²�̼���Ƶ�����Һ������ձ���ϲ���������Һ����Ͽڵ��� afg �� ���ܲ���̼������Һ��������Һ�嵹�� �� ��������������������Һ�л�ˮ�����������ƺ��Ҵ���ʹ������������С ������������ϩ�����ѵȣ���ʹ�Ҵ�̿�������������������γ������� ʹ���������ƿɼ��ٸ����ͬʱ����ѭ��ʹ��
��������
��1��������Ҵ��ӷ����������ȣ����Լ���������Ҵ��Ļӷ������������Ҵ���ת���ʻ������ʣ�
��Ϊ����������Ҵ��ӷ���������ʵ�ת���ʣ�
��2����������Ҵ����Һ���ȹ������������������������Ƭ�ɷ�ֹ���У�������L�������������������ûӷ���������Ҵ����������ΪҺ�壬���䵽��ƿ�У����������Ҵ��������ʣ�
��Ϊ��ֹ���У������͵�����
��3������ƿ�г��������ʳ��������������⣬������������Ҵ��������ˮ���գ�������������������Ҵ����ʣ�����ձ���Ӧ��ˮ���ɱ���̼������Һ��̼������Һ�������������Ҵ�����ȥ���ᣬ��������������ˮ�е��ܽ��ʹ֮�����������������ܶ�С��ˮ�����й���ζ���Ľ���ʵ��������C�ձ���Һ����ֲַ㣬�ϲ�Һ����й���ζ������״��������������������÷�Һ�ķ�������������ǽ�C�ձ���Һ�������ò���������ע���Һ©������á��ֲ㣬��Һ©�����������²�̼���Ƶ�����Һ������ձ���ϲ���������Һ����Ͽڵ�����ʹ�õ��������Ƿ�Һ©�����ձ�������������afg��ȷ��
��ΪC����Һ���ɱ���̼������Һ�� C�ձ���Һ��ֲ㡢�ϲ�Һ����й���ζ���ҳ���״����C�ձ���Һ�������ò���������ע���Һ©������á��ֲ㣬��Һ©�����������²�̼���Ƶ�����Һ������ձ���ϲ���������Һ����Ͽڵ�����afg��
��4����װ��C�е���©����������Ŀ�ģ�ͼ2��Dװ�ò��ܷ�ֹ��������˲�����ͼ2����ͼ1��Cװ�ã�
��Ϊ���ܲ���̼������Һ��������Һ�嵹����
������������NaOH��Һ��ˮ��������ƺ��Ҵ�����˲�����ͼ2��Eװ�ô���ͼ1��Cװ�ã�
��Ϊ����������������������Һ�л�ˮ�����������ƺ��Ҵ���ʹ������������С��
��5��Ũ���������ˮ�Ժ�ǿ�����ԣ�Ũ�����������࣬����Ũ�������ˮ�ԣ�ʹ�Ҵ�̼��������SO2��CO2�ȣ��Ҵ���Ũ���������·�����ȥ��Ӧ��ȡ����Ӧ��������ϩ�����ѵ����ʣ�NaHSO4��������ˮ�Ժ�ǿ�����ԣ�ʹ���������ƿ��Լ��ٸ����ͬʱ�������Ʋ������л����Ӧ����տ���ѭ��ʹ�ã�
��Ϊ������������ϩ�����ѵȣ���ʹ�Ҵ�̿�������������������γ������ȣ�ʹ���������ƿɼ��ٸ����ͬʱ����ѭ��ʹ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 mol ���ۼ������յ��������γ�1 mol ���ۼ����ͷŵ�������Ϊ���ܡ���֪��H��H����Ϊ436 kJ /mol��H��N����Ϊ391 kJ /mol�� N2 (g)+ 3H2(g) ![]() 2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����(����)
2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����(����)
A. H��H��N��N���ι�
B. N��N����ԼΪ946 kJ/mol
C. �ϳɰ���Ӧѡ���ʵ��Ĵ�����Ϊ�����H2��ת����
D. 0.5 mol N2��1.5 mol H2����������³�ַ�Ӧ���ų�����Ϊ46.2 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������500mL 0.2mol/L��NaOH��Һ��
(1)����ͼ��ʾ�����У�����������Һ�϶�����Ҫ����_____________(�����)����ͼ�����������⣬����������Һ����Ҫ�IJ���������__________��____________��
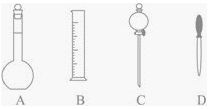
(2)��д���������еĿհף�
���岽�����£�
�ټ�����Ҫ����NaOH���������___________g��
����������ƽ����NaOH���壻
�۽��ƺõ�NaOH��������ձ��У�����������ˮ�ܽ⡢���裬��_________�����£�
�ܽ�NaOH��Һ�ز�����ע��____________�У�
������������ˮϴ���ձ��ڱ�2��3�Σ�ϴ��ҺҲ��ע������ƿ������ζ�����ƿ��ʹ��Һ��Ͼ��ȣ�
������ˮע������ƿ��Һ����̶�����_______cmʱ������____________�μ�����ˮ��Һ���ڿ̶������У�
�߸Ǻ�ƿ�����������µߵ���ҡ�ȣ�
(3)����ȷ���������������Һ���ʵ���Ũ��Ϊ0.192mol/L��ԭ�������_____________
A.ʹ����ֽ����NaOH���壻
B.�ܽ�NaOH����ձ�δ�����ϴ�ӣ�
C.����ƿ��ԭ������������ˮ��
D.����ʱ���õ��������⣻
E.δ��ȴֱ��ת��������ƿ��������á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£�1.7g������ռ�����Ϊ__L�������״����__L���⺬����ͬ��Ŀ����ԭ�ӡ�
��2��ͬ��ͬѹ�£�SO2�뺤�����ܶ�֮��Ϊ___����������ͬ����������������֮��Ϊ___���������ͬ���������������֮��Ϊ___��
��3���ڱ�״���£���4gH2����11.2LO2����1molH2O�У�����������������(����ţ���ͬ)___����ԭ����������___������������___�������С����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������װ��ͼ�����а�ĤΪ����Ĥ���ס���װ����A��B��a��b��ҺŨ�ȷֱ���MA��MB��Ma��Mb��ʾ���ҡ���װ�÷ֱ��ʾһ��ʱ���ס���װ�õ�״̬��Һ�������ĸ߶ȷֱ�Ϊh1��h2�����A��B��a��b��Ϊ������Һ����MA>MB��Ma��Mb>MA����ﵽƽ���(����)
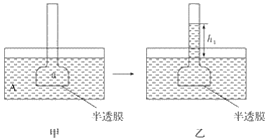
A. h1>h2��Ma>MbB. h1>h2��Ma<Mb
C. h1<h2��Ma<MbD. h1<h2��Ma>Mb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����
A. �ױ�������Һ���Ϻ������������![]()
B. ʵ�����Ʊ���ϩʱ���¶ȼ�ˮ����Ӧ�ò���Ũ�������ˮ�Ҵ��Ļ��ҺҺ������
C. ���������м���NaOH��Һ���ȣ���ַ�Ӧ���ټ���AgNO3��Һ����������ɫ������֤���������к�����Ԫ��
D. �Ʊ�����Cu��OH��2����Һʱ����4��6��2����NaOH��Һ����2mL2����CuSO4��Һ�У��ߵα���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. ��������Һ������ȩ�е�ȩ����CH3CHO+2Ag(NH3)2+ +2OH�� ![]() CH3COONH4 +3NH3+2Ag��+H2O
CH3COONH4 +3NH3+2Ag��+H2O
B. ��������Һ��ͨ������CO2��CO2 +H2O+2C6H5O����2C6H5OH+CO32��
C. �������е���AgNO3��Һ����������Ԫ�أ�Cl��+Ag+=AgCl��
D. �������������ͭ����Һ�У�2CH3COOH+Cu(OH)2=Cu2++2CH3COO-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ù�ҵ����ʯ����������SiO2��Al2O3��Fe2O3�����ʣ���ȡCaCl2��6H2O��������������̣�
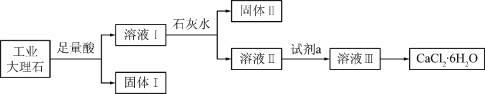
����˵������ȷ����
A. ����I���SiO2������II���Fe(OH)3
B. ʹ��ʯ��ˮʱ��Ҫ����pH����ֹ����II��Al(OH)3ת��ΪAlO2-
C. �Լ�aѡ�����ᣬ����ҺIII�õ�CaCl2��6H2O��Ʒ�Ĺ����У������������ֹ��ֽ�
D. ���ı�ʵ�鷽��������ҺI��ֱ�ӼӰ�ˮ��������ȫ����ȥ����������Һ������Ũ������ȴ�ᾧҲ�ɵõ�����CaCl2��6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ��ͳ����ܽ�ƽ�⣬���Ƕ��ɿ�����ѧƽ�⡣�������ѧ֪ʶ�ش��������⣺
(1)AlCl3��Һ��______��(��ᡱ���С����)ԭ����_________________________(�����ӷ���ʽ��ʾ)������AlCl3��Һ���ɣ����գ������Ҫ�õ����������________������AlCl3��Һ��NaHCO3��Һ��ϣ��÷�Ӧ�����ӷ���ʽΪ__________________________________________��
(2)��1L0.2 mol��L��1HA��Һ��1L0.1 mol��L��1NaOH��Һ��������(��Ϻ���Һ����仯���Բ���)����û����Һ��c(Na��)>c(A��)����
�ٻ����Һ�У�c(A��)________c(HA)(�>����<����������ͬ)��
�ڻ����Һ�У�c(HA)��c(A��)________0.1 mol��L��1��
(3)�����£���NaOH��Һ��c(OH��)��NH4Cl��Һ��c(H+)��ͬ���ֽ�NaOH��Һ��NH4Cl��Һ�ֱ�ϡ��10����ϡ�ͺ�NaOH��Һ��NH4CI��Һ��pH�ֱ���pH1��pH2��ʾ����pH1 +pH2________(�>����<������)14��
(4)pH��ͬ�Ģ�CH3COONa����NaHCO3����NaClO������Һ��c(Na��)��___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com