
【题目】将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应: 2H2O(g)![]()
2H2+O2,2CO+O2![]() 2CO2。
2CO2。
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是________和________,或________和________。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为:n平(O2)= a mol, n平(CO2)=bmol。试求n平(H2O)=________。(用含a、b的代数式表示)
【答案】(1)H2O H2 CO CO2
(2)(22ab)mol
【解析】(1)根据C、H元素守恒:n平(H2O)+n平(H2)= 2 mol; n平(CO)+n平(CO2)= 2 mol,显然n平(H2O)和n平(H2)或n平(CO)和n平(CO2),只要知道其中一个,另一个也就确定,同时知道两个是没有意义的。
(2)根据n平(O2)和n平(CO2)求n平(H2O)有以下两种方法:
① 三步法:第一步反应生成的O2的平衡量看做第二步反应的O2的起始量
2H2O(g)![]() 2H2+O2
2H2+O2
起始量/mol :2 0 0
变化量/mol:x x 0.5x
平衡量/mol:2x x 0.5x
2CO + O2 ![]() 2CO2
2CO2
起始量/mol :2 0.5x 0
变化量/mol:y 0.5y y
平衡量/mol :2y 0.5x0.5y y
可得0.5x0.5y=a;y=b
解得:x=2a+b,n平(H2O)= 2x=(22ab)mol。
② 逐步逆推法:因为第二个反应的反应物O2是第一个反应的生成物,所以可以从第二个反应消耗O2的量逆推出第一个反应生成O2的量,进而推出第一个反应消耗的H2O的量。
第二个反应生成b mol CO2,说明第二个反应消耗0.5b mol的O2,所以第一个反应生成(a+0.5b)mol的O2,第一个反应消耗(2a+b)mol H2O,得n平(H2O)=(22ab)mol。


科目:高中化学 来源: 题型:
【题目】在pH=1的无色溶液中,下列离子能大量共存的是( )
A.NH4+、Ba2+、NO3﹣、CO32﹣
B.Fe2+、OH﹣、SO42﹣、MnO4﹣
C.K+、Mg2+、NO3﹣、SO42﹣
D.Na+、Fe3+、Cl﹣、AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
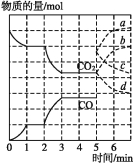
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)= 。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH 0(填“>”“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是 (填写编号)。
A.v(正)先增大后减小 B.v(正)先减小后增大
C.v(逆)先增大后减小 D.v(逆)先减小后增大
表示n(CO2)变化的曲线是 (填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是( )
A.pH值都为4的稀盐酸和NH4Cl溶液中,水的电离程度相同
B.浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后:lg[ ![]() ]=0
]=0
C.在含浓度都为0.01mol/L的Cl﹣、CrO42﹣的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.9×10﹣12]
D.浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)2ClNO(g)△H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H3的平衡常数K=(用K1、K2表示).△H3=(用△H1、△H2表示).
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应a达到平衡.测得10min内V(ClNO)=7.5×10﹣3molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2 , α1α2(填“>”“<”或“=”),平衡常数K1(填“增大”“减小”或“不变”).若要使K1减小,可采用的措施是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知废旧干电池中的填充物主要有二氧化锰、炭黑、氯化锌、氯化铵、淀粉糊、Mn2O3、ZnO、FeO、汞的化合物等.某实验小组的同学拟回收废旧电池中的部份物质,主要操作流程如图:  下列说法不正确的是( )
下列说法不正确的是( )
A.步骤①②的名称分别为溶解、过滤
B.步骤③中使用的化学仪器有酒精灯、三角架、泥三角、坩埚、玻璃棒
C.步骤①②③中都使用了玻璃棒,且三个操作中玻璃棒的作用不完全相同
D.步骤④的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的 是( ) 
A.若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银
B.甲池通入 CH3OH 的电极反应式为 CH3OH+6e﹣+2H2O═CO32﹣+8H+
C.反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4溶液恢复到 原浓度
D.甲池中消耗 224mL(标准状况下)O2 , 此时丙池中理论上产生 1.16g 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积可变的密闭容器中发生反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)。
Fe3O4(s)+4H2(g)。
回答下列问题:
(1)增加Fe的量,正反应速率 (填“增大”、“减小”或“不变”,下同)。
(2)将容器的容积缩小一半,正反应速率 ,逆反应速率 。
(3)保持容器的容积不变,充入N2使体系压强增大,正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的容积增大,正反应速率 ,逆反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如表,则M离可能为( )
所含离子 | NO3﹣ | SO42﹣ | H+ | M |
浓度/(molL﹣1) | 2 | 1 | 2 | 1 |
A.Cl﹣
B.Ba2+
C.Na+
D.Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com