
| ||
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 120 | ||||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 80 |

| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | |||||
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响(2分) | 280 | 6.50×10-3 | 4.00×10-3 | |
| Ⅲ | 6.50×10-3 | 4.00×10-3 |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沙里淘金 |
| B、利用磁铁分离铁屑和沙混合物 |
| C、利用自来水制备蒸馏水 |
| D、粗盐提纯中除去粗盐含有的可溶性杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg?kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表各组物质中,满足如图物质(或其水溶液)一步转化关系的选项是( )
下表各组物质中,满足如图物质(或其水溶液)一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | Na2O |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Cl2 | FeCl2 | FeCl3 |
| D | CO2 | Na2CO3 | NaHCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
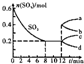 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )| A、用O2表示0~8 min内该反应的平均速率为0.025 mol?(L?min)-1 |
| B、升高温度,达到新平衡时的化学平衡常数比原平衡的小 |
| C、容器内压强保持不变时反应处于平衡状态 |
| D、第12min时,容器压强到1L,则SO3的变化曲线为a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液氯储存在钢瓶中 |
| B、浓硫酸储存在铝制容器中 |
| C、金属钠保存在煤油中 |
| D、氢氧化钠溶液保存在带玻璃塞的玻璃试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com