
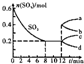
 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )| A、用O2表示0~8 min内该反应的平均速率为0.025 mol?(L?min)-1 |
| B、升高温度,达到新平衡时的化学平衡常数比原平衡的小 |
| C、容器内压强保持不变时反应处于平衡状态 |
| D、第12min时,容器压强到1L,则SO3的变化曲线为a |
| 0.4mol |
| 2L×8min |
| 0.025mol/(L?min) |
| 2 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 120 | ||||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 80 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3- |
| B、CO32- |
| C、Cl- |
| D、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象或反应 | 原理解释 | |
| A | 锌与盐酸反应时,加入几滴氯化铜溶液可加快反应速率 | 氯化铜作反应的催化剂 |
| B | 将一小块金属钠投入水中,金属钠熔成小球 | 该反应△H>0 |
| C | 镀层破损后,镀锡铁比镀锌铁易腐蚀 | 锡比锌活泼 |
| D | 常温下,测得0.1mol/L醋酸溶液的pH=4 | 醋酸是弱电解质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C8H18(1)+
| ||||
B、C8H18(1)+
| ||||
| C、H+(aq)+OH-(aq)═H2O(aq);△H=一57.3 kJ?mol-1 | ||||
D、NaOH(aq)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上用电解熔融氯化钠的方法制取钠 |
| B、钠加入氯化镁的饱和溶液中可以制取金属镁 |
| C、电解冶炼铝的原料是氯化铝 |
| D、碳在高温下能还原氧化镁中的镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com