
| ||
| ||


科目:高中化学 来源: 题型:
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
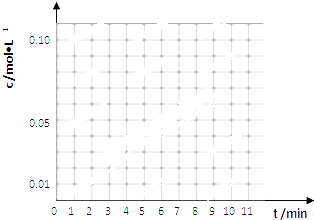
查看答案和解析>>
科目:高中化学 来源: 题型:
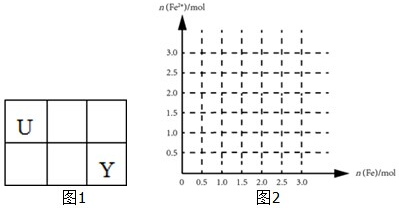
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表各组物质中,满足如图物质(或其水溶液)一步转化关系的选项是( )
下表各组物质中,满足如图物质(或其水溶液)一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | Na2O |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Cl2 | FeCl2 | FeCl3 |
| D | CO2 | Na2CO3 | NaHCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
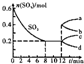 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )| A、用O2表示0~8 min内该反应的平均速率为0.025 mol?(L?min)-1 |
| B、升高温度,达到新平衡时的化学平衡常数比原平衡的小 |
| C、容器内压强保持不变时反应处于平衡状态 |
| D、第12min时,容器压强到1L,则SO3的变化曲线为a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和吸水性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌片做负极,锌发生还原反应 |
| B、铜片做正极 |
| C、溶液中的pH值增大 |
| D、溶液中的H+向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com