
����Ŀ������NaBH4/H2O2ȼ�ϵ�أ�DBFC���Ľṹ��ͼ��ʾ������֪���⻯������Ϊ-1�ۣ����йظõ�ص�˵����ȷ����
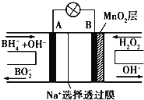
A���缫B�����к�MnO2�㣬MnO2����ǿ������
B����ظ������ĵ缫��Ӧ��BH4-+8OH--8e-��BO2-+6H2O
C���ŵ�����У�Na+������������Ǩ��
D���ڵ�ط�Ӧ�У�ÿ����1L6mol/LH2O2��Һ��������������·�еĵ���Ϊ6NA��
���𰸡�B
��������
���������A���缫B����MnO2��Ϊ������H2O2������ԭ��Ӧ���õ����ӱ���ԭ����OH-��MnO2�����缫�������д����ã���A����B����������������Ӧ���缫��ӦʽΪBH4-+8OH--8e-=BO2-+6H2O����B��ȷ��C���ŵ�ʱ���������������ƶ�����C����D���ڵ�ط�Ӧ�У�ÿ����1L 6mol/L H2O2��Һ��������������·�еĵ�����=6mol/L��1L��2��NA/mol=12NA����D����ѡB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��C(s)+H2O(g)=CO(g)+H2(g) ��H=akJ/mol
2C(s)+O2(g)=2CO(g) ��H=-220kJ/mol��H-H��O=O��O-H���ļ��ֱܷ�Ϊ436��496��462kJmol-1����aΪ��������
A��-332 B��-118 C��+350 D��+130
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������粒㷺Ӧ���빤ũ�����У�����������ͼ���£��ش��������⣺
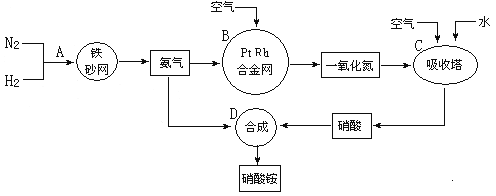
��1����������ҵ������������У�B�豸�������� ���ڷ�Ӧ�е����������� ��
��2�������������У�N2��H2�ϳ�NH3���õĴ����� ���ںϳɰ����豸(�ϳ���)�У������Ƚ�������Ŀ���� ���ںϳ��������������ͨ�������Ŀ���� ��
��3����ѧ����(NH3)Ϊȼ�Ͽ������͵�ȼ�ϵ������������ɴ���O2�����ӵ� MnO3�������ʣ�����ܷ�ӦΪ��4NH3+3O2=2N2+6H2O�������ĵ缫��ӦʽΪ ��
��4��ij���ʳ���NH3�Ʊ�NH4NO3����֪����NH3��NO�IJ�����96%��NO��HNO3�IJ�����92%������HNO3����ȥ��NH3������Լռ�ܺ�NH3����(�������������)�� %��(ȡ��λ��Ч����)
��5���������һ�ֳ��õĵ��ʣ���ʹ�øû���ʱ��������Է���һ��ʹ�ã������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����C(s)��1/2O2(g)��CO(g)�� ��H����110.5 kJ��mol��1
��C(s)��O2(g)��CO2(g) �� ��H����393.51 kJ��mol��1
��ӦC(s)��CO2(g)��2CO(g)����HΪ
A����283.01 kJ��mol��1
B����172.51 kJ��mol��1
C����283.01 kJ��mol��1
D����172.51 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
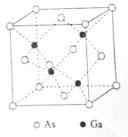
����Ŀ���黯�أ�GaAs���������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȡ��ش��������⣺
��1��д����̬Asԭ�ӵ������������ĵ����Ų�ͼ________________________��
��2������Ԫ�������ɣ�ԭ�Ӱ뾶Ga______As����һ������Ga_____As��������ڡ���С�ڡ���
��3��AsCl3���ӵ����幹��Ϊ____________________������As���ӻ��������Ϊ_________��
��4��GaF3���۵����1000����GaCl3���۵�Ϊ77.9������ԭ����_____________________��
��5��GaAs���۵�Ϊ1238�����ܶ�Ϊ��g��cm3���侧���ṹ��ͼ��ʾ���þ��������Ϊ________________,Ga��As��________�����ϡ�Ga��As��Ħ�������ֱ�ΪMGa g��mol1��MAs g��mol1��ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAs pm�������ӵ�����ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ������ ��
A��̼ԭ�Ӽ��Ե�����������������
B�������������ʵ���ɷ���Cn��H2O��mͨʽ
C����֬�й̶����۷е�
D������������ǻ�Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������;�㷺����������(��Ҫ�ɷ�ΪAl2O3��nH2O������SiO2��Fe2O3)��ȡAl������;����

��1����ҺA�����ھ�ˮ���侻ˮԭ�������ӷ���ʽ��ʾΪ_________________��
��2������ʱʢ��ҩƷ������������______________
��3���������з�����Ӧ�Ļ�ѧ����ʽ��________________________��
��4�������������ɹ���C�����ӷ�Ӧ����ʽΪ__________________________��
��5��ȡ��ҺB 100 mL������1 mol/L����200 mL���������ﵽ���������Ϊ11.7 g������ҺB��c(Al O2-)=_____________����4�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϵͳ����������������������ȷ����
A��2-��-3-�һ����� B��3,4,4-��������
C��2-��-4-�һ����� D��1,2-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��250���� 1��01��105Paʱ��2N2O5��g��= 4NO2��g��+ O2��g�� ��H=+56��76 kJ/mol ���Է����У����Է����е�ԭ����
A�������ȷ�Ӧ
B���Ƿ��ȷ�Ӧ
C�����ؼ��ٵķ�Ӧ
D������ЧӦ��������ЧӦ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com