
【题目】(1)无机化合物可根据其组成和性质进行分类:
ⅰ、下图所示的物质分类方法名称是________。
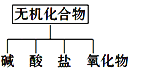
ⅱ、以Na、K、H、O、C、S中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② __ | ③ __ ④ Ba(OH)2 | ⑤ Na2CO3 ⑥ ___ | ⑦ CO2 ⑧ H2O |
ⅲ、 写出⑦通入到过量的④溶液中的离子方程式:_________。
ⅳ、 实验室检验气态⑧的方法是___________。
(2)某无色透明溶液,跟金属铝反应放出H2,判断下列离子:Mg2+、Ba2+、Cu2+、H+、Ag+、SO42-、SO32-、OH-、HCO3-、NO3-,哪种离子能大量存在于此溶液中。
ⅰ、 生成Al3+时,原无色透明溶液能够大量存在的离子有_______。
ⅱ、生成AlO2-时,原无色透明溶液能够大量存在的离子有_____。
【答案】树状分类法 H2SO4 或H2SO3 或H2CO3或H2S或H2C2O4(合理即可) NaOH或 KOH K2CO3或K2SO3或K2SO4或Na2SO3或Na2SO4(合理即可) Ba2++2OH-+CO2 = BaCO3↓+H2O 将该气体通入无水硫酸铜固体中,若无水硫酸铜变蓝色,则证明该气体为H2O Mg2+、H+、SO42- Ba2+、OH-、NO3-
【解析】
(1)i、根据交叉分类法和树状分类法的定义分析判断;
ii、以Na、K、H、O、C、S六种元素中任意两种或三种元素可组成酸、碱、盐、氧化物等,根据常见的物质的化学式书写;
ⅲ、 ⑦CO2通入到过量的④[Ba(OH)2]溶液中反应生成碳酸钡沉淀,据此书写反应的离子方程式;
ⅳ、 实验室常用无水硫酸铜固体检验水蒸气;
(2)溶液无色,则一定不存在有色的Fe3+离子,与铝反应生成氢气,则溶液中存在大量氢离子或氢氧根离子。i、当生成Al3+时,说明溶液呈酸性;ii、当生成AlO2-时,说明溶液呈碱性,据此分析解答。
(1)ⅰ、交叉分类法是根据物质不同的分类标准,对同一事物进行多种分类的一种分类方式,树状分类法是对同一类事物按照某些属性进行在分类的分类法,无机化合物可根据其组成和性质进行分类:无机化合物、盐、碱、酸、氧化物、氢化物属于树状分类法,故答案为:树状分类法;
ⅱ、以Na、K、H、O、C、S六种元素中任意两种或三种元素可组成酸有:H2SO4、H2CO3、H2SO3 、H2CO3、H2S或H2C2O4,碱有:NaOH、KOH,盐有:K2CO3、Na2CO3、K2SO3、Na2SO3、K2SO4、Na2SO4,故答案为:H2SO4 或H2SO3 或H2CO3或H2S或H2C2O4;NaOH或KOH;K2CO3或K2SO3或K2SO4或Na2SO3或Na2SO4;
ⅲ、 ⑦CO2通入到过量的④[Ba(OH)2]溶液中反应生成碳酸钡沉淀,反应的离子方程式为Ba2++2OH-+CO2 = BaCO3↓+H2O,故答案为:Ba2++2OH-+CO2 = BaCO3↓+H2O;
ⅳ、 实验室常用无水硫酸铜固体检验水蒸气,方法为将该气体通入无水硫酸铜固体中,若无水硫酸铜变蓝色,则证明该气体为H2O,故答案为:将该气体通入无水硫酸铜固体中,若无水硫酸铜变蓝色,则证明该气体为H2O;
(2)无色透明溶液,说明原溶液中不存在Cu2+;铝既能与酸作用产生氢气,也能与碱作用产生氢气。
ⅰ、当溶液显酸性时,铝与酸反应生成Al3+,溶液显酸性,则SO32-、HCO3-、OH-不能大量存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-;根据溶液不显电性,一定存在阴离子,即溶液中肯定有SO42-,而Ag+、Ba2+可与SO42-生成沉淀,说明原溶液中也不存在Ag+、Ba2+,此时溶液中一定含H+、SO42-,可能存在Mg2+离子,故答案为:H+、SO42-、Mg2+;
ⅱ、当溶液显碱性时,铝与碱反应生成AlO2-,在碱性溶液中Mg2+、Cu2+、H+、Ag+、HCO3-不能大量存在,根据溶液不显电性,一定存在阳离子,一定含有Ba2+,根据离子共存可知原溶液中的阴离子只能是OH-、NO3-,则原溶液中一定存在的离子为OH-、Ba2+,可能存在NO3-,故答案为:OH-、Ba2+、NO3-。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJmol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJmol-1
已知Al的燃烧热为 △H3=ckJmol-1,则MnO2与Al发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,Mn2+的产率为____________。
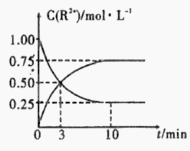
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关内容。
(1)咖啡含有咖啡因(化学式为C8H10N4O2),则咖啡因的摩尔质量为__________g/mol。
(2)0.2 g H2大约含有________个H原子。
(3)100 mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol/L,其中c(SO42-)= ________mol/L。
(4)8 克O2和O3的混合气体中氧原子的物质的量为 ________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,能达到实验目的的是( )
|
|
A. 制备 | B. 比较 |
|
|
C. 铝热法制备少量铁单质 | D. 排水法收集氢气 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):
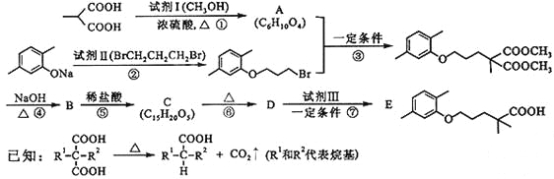
请回答下列问题:
(1)试剂Ⅰ的名称是___a___,试剂Ⅱ中官能团的名称是___b___,第② 步的反应类型是____c___。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液![]() 含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
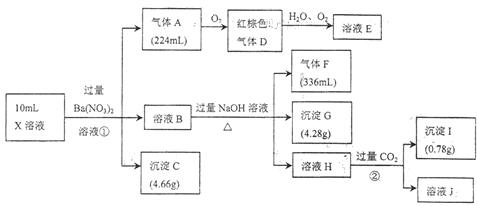
(1)步骤①中生成气体![]() 的离子方程式:________________________。
的离子方程式:________________________。
(2)步骤②生成沉淀Ⅰ的离子方程式:________________________。
(3)一般用铁氰化钾溶液检验溶液中是否存在______离子,请写出涉及的离子方程式:__________________;请设计实验,检验溶液![]() 中是否存在
中是否存在![]() :__________________。
:__________________。
(4)![]() 溶液中______(填“含”或“不含”)
溶液中______(填“含”或“不含”)![]() ,
,![]() ______
______![]() (若填不含,则不需计算)
(若填不含,则不需计算)
(5)通过上述实验,溶液中除![]() 外,一定存在的离子是____________;一定不存在的离子是____________。
外,一定存在的离子是____________;一定不存在的离子是____________。
(6)若测得![]() 溶液中
溶液中![]() ,则
,则![]() 溶液中
溶液中![]() ______
______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了研究“干燥的CO2不能与Na2O2反应”和“CO2在有水存在时才能与Na2O2反应”,设计了如下实验装置:

(1)如图装置,在干燥管中装入Na2O2后,打开活塞加入稀硫酸,生成CO2。打开K1,关闭K2,加热铜丝,目的是_____,X是_____。实验观察到铜丝未变化,则得出结论______。
(2)若打开K2,关闭K1,出现________现象,可证明有水时CO2与Na2O2反应产生了O2。
(3)根据以上的实验结论,写出生成CO2、O2反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____,X和Y中电负性较大的是__(填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________。
(3)X与M形成的XM3分子的空间构型是__________。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________(填离子符号)。
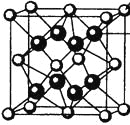
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
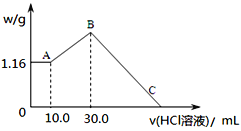
①A点的沉淀物的化学式为______________。
②写出A点至B点发生反应的离子方程式:_________________。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:NaOH溶液、_______和盐酸。
④C点(此时沉淀恰好完全溶解)HCl溶液的体积为________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com