
����Ŀ����4molA�����2molB������2L���ܱ������л��,����һ�������·������·�Ӧ��2A(g)+B(g)![]() xC(g),����2s����A�����ʵ���Ϊ2.8mol��C�����ʵ���Ũ��Ϊ0.6mol/L������˵������ȷ����
xC(g),����2s����A�����ʵ���Ϊ2.8mol��C�����ʵ���Ũ��Ϊ0.6mol/L������˵������ȷ����
A. 2s������A��ƽ����Ӧ����Ϊ0.6mol-1��l-1��s-1 B. 2sʱ����B��ת����Ϊ70��
C. 2s������B��ƽ����Ӧ����Ϊ0.6mol-1��l-1��s-1 D. x��2
���𰸡�D
��������
����2s����A�����ʵ���Ϊ2.8mol������A��4mol��2.8mol��1.2mol��C�����ʵ���Ũ��Ϊ0.6mol/L������C��0.6mol/L��2��1.2mol�����ݷ���ʽ��֪x��2����
2A(g)+B(g)![]() 2C(g)
2C(g)
��ʼ����mol�� 4 2 0
�仯����mol�� 1.2 0.6 1.2
ƽ������mol�� 2.8 1.4 1.2
A��2s��������A��ʾ��ƽ����Ӧ����Ϊ![]() ��0.3molL-1s-1��A����
��0.3molL-1s-1��A����
B��2sʱ����B��ת����Ϊ0.6mol/2mol��100%��30%��B����
C����Ӧ����֮���ǻ�ѧ������֮�ȣ���2s��������B��ʾ��ƽ����Ӧ����Ϊ0.15molL-1s-1��C����
D�������������֪x��2��D��ȷ��
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϣʱ�������Ĵ������������Ի��������˼������в��ij�����Ϊ����ѧ��̽��С�齫һ����������·������õ���70%Cu��25%Al��4%Fe������Au��Pt�Ƚ����Ļ�������Ƴ������Ʊ�����ͭ�������������·�ߣ�

��ش��������⣺
(1)�ڢٲ�Cu���ᷴӦ�����ӷ���ʽΪ__________________���õ�����1����Ҫ�ɷ�Ϊ______��д��ѧʽ����
(2)�ڢڲ���H2O2��������______________________�������ӷ���ʽ��ʾ����ʹ��H2O2���ŵ���____________������ҺpH��Ŀ����ʹ____________���ɳ�����
(3)�õڢ۲�����CuSO4��5H2O�Ʊ���ˮCuSO4�ķ�����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25�棬101kPa�£�lgC8H18�����飩ȼ�����ɶ�����̼��Һ̬ˮʱ�ų�48.40kJ��������ʾ������Ӧ���Ȼ�ѧ����ʽ��ȷ����( )
A. C8H18��1����12.5O2��g����8CO2��g����9H2O��g�� ��H����48.40kJ��mol��1
B. C8H18��1����12.5O2��g����8CO2��g����9H2O��1�� ��H����5518kJ��mol��1
C. C8H18��1����12.5O2��g����8CO2��g����9H2O��1�� ��H����5518kJ��mol��1
D. C8H18��1����12.5O2��g����8CO2��g����9H2O��1�� ��H����48.40kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A.������Һ�ʼ��ԣ�������ȥ����
B.SO2���������ԣ�������Ư��ֽ��
C.NH3���л�ԭ�ԣ������������
D.FeCl3��Һ�����ԣ�������ӡˢ��·���ʴ�̼�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ����NO3����ԭ����ͼ��ʾ��
(1)��ԴA��Ϊ_____(��������������������)��������ӦʽΪ_____��
(2)����������ת����1mol���ӣ���Ĥ�����Һ������������Ϊ_____g��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�м׳ص��ܷ�ӦʽΪ2CH3OH��3O2��4KOH=2K2CO3��6H2O������˵����ȷ���� ( )
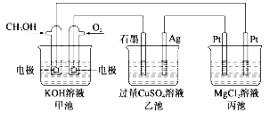
A���׳ص���ת��Ϊ��ѧ�ܣ��ҡ����ػ�ѧ��ת��Ϊ����
B���׳���ͨ��CH3OH�ĵ缫��ӦʽΪ�� CH3OH��6e����2H2O= CO��8H��
C����������280 mL(��״����)O2ʱ������������������1.45 g����
D�� ��Ӧһ��ʱ������ҳ��м���һ����Cu(OH)2������ʹCuSO4��Һ�ָ���ԭŨ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӱ��ˮ�ĵ���ƽ��IJ����ǣ���
A.��ˮ��Ͷ��һС�������B.��ˮ�������C.��ˮ��ͨ��CO2���� D.��ˮ�м�ʳ�ξ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ����մɾ�Ϊ��������Ʒ�������й�˵����ȷ���ǣ� ��
A.��������������ʹ�õĹ�������Ʒ
B.����ˮ�����Ҫԭ��Ϊ���ʯ��ʯ��ʯӢ
C.��������Ʒ�������ȶ����۵�ϸ�
D.����ˮ��Ĺ�����ֻ�����������仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com