
【题目】Ⅰ.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)砷与磷为同一主族元素,砷的原子序数为________________。
(2)根据元素周期律,下列说法正确的是__________________。
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______。
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:
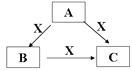
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为________(写元素名称),它在周期表中的位置为______。
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为________。
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为______。
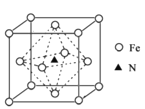
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为______。
(7)某铁的化合物结构简式如图所示:
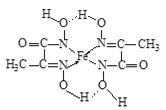
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
【答案】33 ac 4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+ 铝 第三周期第ⅢA族 2Al+Fe2O3 ![]() 2Fe+Al2O3 1s22s22p63s23p63d5 4∶1 O>N>C>H sp2、sp3
2Fe+Al2O3 1s22s22p63s23p63d5 4∶1 O>N>C>H sp2、sp3
【解析】
(1)磷原子核外电子数为15,砷与磷为同一主族元素,则砷的原子序数15+18=33,故答案为:33;
(2)a.同周期自左而右,非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下,非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4,故a正确;b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确;故答案为:ac;
(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁,反应的离子方程式为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+,故答案为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+;
Ⅱ.(4)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,则C为偏铝酸根,将A、C的水溶液混合可得B的白色胶状沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,x为氢氧化钠。
①A、B、C中含有的同一种常见金属元素为铝,它在周期表中的位置为第三周期第ⅢA族,故答案为:铝;第三周期第ⅢA族;
②铝与氧化铁在高温下反应生成氧化铝和铁,常用于焊接铁轨及定向爆破,该反应的化学方程式为2Al+Fe2O3 ![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3 ![]() 2Fe+Al2O3;
2Fe+Al2O3;
Ⅲ.(5)Fe是26号元素,核外电子排布式为1s22s22p63s23p63d64s2,先失去4s能级2个电子、再失去3d能级1个电子形成Fe3+,Fe3+基态核外电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(6)氮化铁晶体中:氮原子位于体内,只有1个,铁原子个数为:8×![]() +6×
+6×![]() =4个,所以该晶体中铁、氮的微粒个数之比为4∶1;故答案为:4∶1;
=4个,所以该晶体中铁、氮的微粒个数之比为4∶1;故答案为:4∶1;
(7)①同周期从左向右,电负性逐渐增大,非金属性越强,电负性越大,故电负性大小为O>N>C>H,故答案为:O>N>C>H;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化,故答案为:sp2、sp3。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】化合物M( )是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
)是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
A.所有原子不可能处于同一平面
B.可以发生加聚反应和缩聚反应
C.与 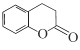 互为同分异构体.
互为同分异构体.
D.1 mol M最多能与1mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取 m1g 样品),请回答每个方案中的问题。
(方案Ⅰ)选用重量法进行测定:可用如图中的装置进行实验。
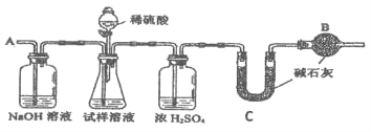
(1)A装置中NaOH溶液的作用是_________;若直接向试样溶液中鼓入空气会导致实验测定结果_________(填“偏高”、“偏低”或“无影响”)。
(2)该方案需直接测定的物理量是_________。
(方案Ⅱ)选用滴定法进行测定:
(3)称取m1g样品,配成100mL溶液,取出20mL,用c mol/L的标准HCl溶液滴定,消耗体积为vmL,则该试样中碳酸氢钠质量分数的计算式为:_________。
(方案Ⅲ)选用气体体积法进行测定:可用上图中的装置进行实验。
(4)为了减小实验误差,量气管中加入的液体X为_________。
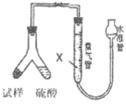
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是_________。
a测定气体体积时未冷却至室温
b测定气体体积时水准管的水面高于量气管的水面
c Y型管中留有反应生成的气体
d气体进入量气管前未用浓硫酸干燥
(方案Ⅳ)其操作流程如下:
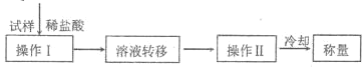
(6)操作Ⅱ的名称是_________。
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是_________。
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)。
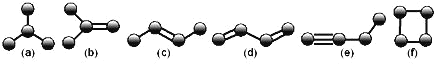
(1)写出有机物(a)的系统命名法的名称_____。
(2)有机物(e)有一种同类别的同分异构体,试写出其结构简式_____。
(3)上述有机物中与(c)互为同分异构体的是_____(填序号)。
(4)写一种与(b)互为同系物且所含碳原子数最少的有机物的结构简式_____。
(5)上述有机物中不能与溴水反应使其褪色的有_____(填序号)。
(6)写出有机物(d)反应生成高分子化合物的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.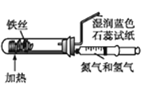 模拟工业制氨气检验产物
模拟工业制氨气检验产物
B.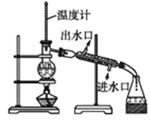 分离沸点不同的两种液体
分离沸点不同的两种液体
C.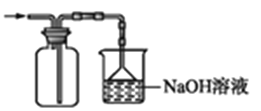 收集并吸收多余的氯气
收集并吸收多余的氯气
D. 盛放浓硝酸
盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】In是第5周期IIIA的元素;In2O3是一种透明的导电材料,可运用于触控屏、液晶显示器等高科技领域;利用水铟矿(主要成分In(OH)3)制备In2O3的工艺流程如下:
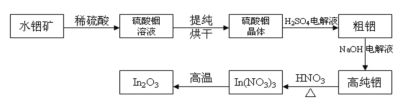
(1)写出水铟矿被硫酸酸溶的离子方程式:_____________________________
(2)从硫酸铟溶液中制备硫酸铟晶体的实验步骤:__________、_________、过滤、洗涤和干燥。
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为___________(填“阴极”、“阳极”),写出阴极的电极反应式_________________________。
(4)完成下列化学方程式:__________
![]() In(NO3)3
In(NO3)3![]()
![]() In2O3
In2O3![]()
(5)已知t℃时,反应In2O3+CO![]() 2InO+CO2的平衡常数K=0.25;
2InO+CO2的平衡常数K=0.25;
i.t℃时,反应达到平衡时,n(CO):n(CO2)=___________;
ii.在1L的密闭容器中加入0.02mol的In2O3(s),并通入x mol的CO,t℃时反应达到平衡。此时In2O3的转化率为50%,则x=_________。
(6)高纯铟和浓硝酸反应过程中产生的NO2气体可以被Na2O2直接吸收,则标准状况下672mlNO2可以被______g Na2O2吸收。NO2的排放会引起一系列的环境问题,任写一条其引起的环境问题:_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是

A. Kal(H2X)的数量级为10-7
B. 曲线N表示lg 与pH的变化关系
与pH的变化关系
C. NaHX溶液中:c(H+)<c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向两个容积相同的烧瓶内分别充入一定量的HCl与NH3(假设烧瓶内其它气体难溶于水)。利用如图所示的装置进行实验,实验开始前各活塞均关闭。
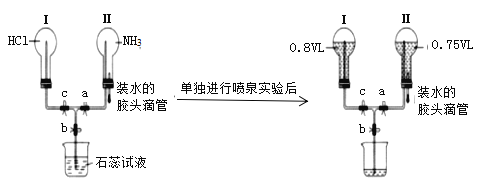
(1)同温同压下,两个烧瓶内充入的HCl与NH3分子数目之比为___,烧瓶Ⅱ中喷泉的颜色是___。
(2)单独进行喷泉实验后,烧瓶I中c(Cl-)=___molL-1(实验条件下气体摩尔体积为Vm)
(3)实验表明,若只是关闭b、打开a、c,则易在烧瓶I中观察到白烟,这表明气体分子扩散速率随着气体相对分子质量的增大而____(填“增大”或“减小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com