
【题目】下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.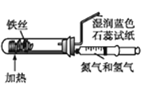 模拟工业制氨气检验产物
模拟工业制氨气检验产物
B.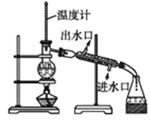 分离沸点不同的两种液体
分离沸点不同的两种液体
C.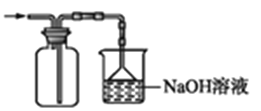 收集并吸收多余的氯气
收集并吸收多余的氯气
D. 盛放浓硝酸
盛放浓硝酸
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中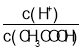 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() >1
>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是( )
A.25 ℃时,0.01 mol·L-1 Na2S水溶液中,pC(H+)+pC(OH-)=14
B.用0.01 mol·L-1的NaOH溶液滴定某浓度的盐酸,滴定过程中pC(OH-)逐渐增大
C.某温度下,A2B难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B2-)=10
D.向0.01 mol·L-1的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pC(Ca2+)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
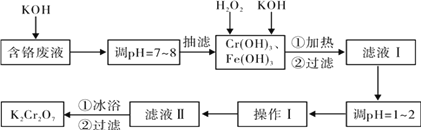
已知:①Cr(OH)3 + OH- = CrO2- + 2H2O; ②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。
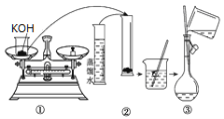
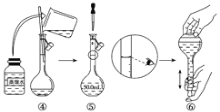
①请你观察图示判断,其中不正确的操作有(填序号)________;
②其中配制250 mL溶液的体积容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是_________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL 淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_________。
②滴定终点的现象为_________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)砷与磷为同一主族元素,砷的原子序数为________________。
(2)根据元素周期律,下列说法正确的是__________________。
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______。
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:
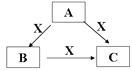
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为________(写元素名称),它在周期表中的位置为______。
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为________。
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为______。
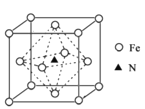
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为______。
(7)某铁的化合物结构简式如图所示:
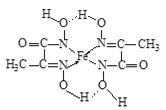
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑![]()
![]() 溶液A
溶液A![]()
![]()
![]() 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是___;证明溶液A不含Fe3+的最佳试剂是___(填序号字母)。
A 酚酞溶液 B KSCN溶液
C 烧碱溶液 D KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、___、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质②______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平___(填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接___;__接___。
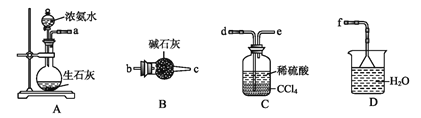
将装置C中两种液体分离开的操作名称是____。装置D的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是

A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)===CO2(g)+N2(g) △H= - 226 kJ·mol-1
C. 反应物的总键能大于生成物的总键能
D. 该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法正确的是( )
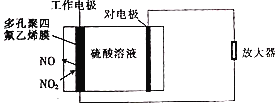
A.“对电极”是正极
B.“工作电极”上发生的电极反应为NO2+2H+-2e﹣═NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物。湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品,从而达到从废旧印刷电路板中提取铜的目的。某化学小组模拟该方法回收铜并制取胆矾,流程简图如下:回答下列问题:
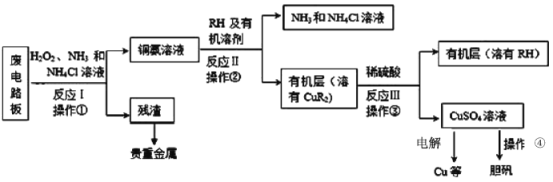
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,NH4Cl溶液主要作用是防止由于溶液中c(OH-)过高,生成__________(填化学式),影响铜的回收率。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,操作2的名称是__________,操作2的主要其目的是(填序号)__________。
a.富集铜元素
b.增加Cu2+在水中的溶解度
c.使铜元素与水溶液中的物质分离
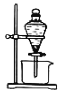
(3)反应Ⅲ的化学方程式为_______,若操作③使用下图装置,图中存在的错误有_______处。
(4)操作④由硫酸铜溶液制胆矾的主要步骤是__________过滤、洗涤、干燥。
(5)流程中可循环使用的试剂除了NH3和NH4Cl溶液以外,还有______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com