
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑![]()
![]() 溶液A
溶液A![]()
![]()
![]() 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是___;证明溶液A不含Fe3+的最佳试剂是___(填序号字母)。
A 酚酞溶液 B KSCN溶液
C 烧碱溶液 D KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、___、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质②______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平___(填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接___;__接___。
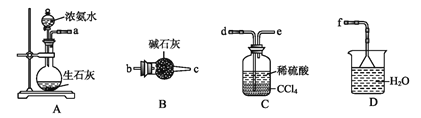
将装置C中两种液体分离开的操作名称是____。装置D的作用是__。
【答案】防止Fe2+被氧化为F![]() B 冷却结晶 减少莫尔盐晶体洗涤中的损耗 左 d e f 分液 吸收多余的NH3防止污染空气,防止倒吸
B 冷却结晶 减少莫尔盐晶体洗涤中的损耗 左 d e f 分液 吸收多余的NH3防止污染空气,防止倒吸
【解析】
废铁屑加稀硫酸溶解,得到硫酸亚铁溶液A,加硫酸铵晶体共同溶解,经过蒸发浓缩、冷却晶体、过滤、洗涤、干燥得到莫尔盐,据此解答。
(1)Fe2+不稳定,易被氧气氧化为Fe3+,剩余少量铁粉防止Fe2+被氧化为Fe3+;检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;操作I是从溶液中获得晶体,其操作为加热蒸发、冷却结晶、过滤;故本题答案为:防止Fe2+被氧化为Fe3+;B;冷却结晶;
(2)洗涤的目的应从两个角度回答:①洗去滤渣中的一些杂质;②防止滤渣溶于洗涤液而损耗,故本题答案为:减少莫尔盐晶体洗涤中的损耗;
(3)遵循“左物右码”原则,药品应放置在左盘内,故本题答案为:左;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,连接顺序为a→d→e→f,
故本题答案为:d;e;f;
(5)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸;故本题答案为:分液;吸收多余的NH3防止污染空气,防止倒吸。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
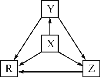
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.Fe(OH)3溶于稀 H2SO4 中:H++OH﹣→H2O
B.氨水滴入AlCl3溶液中:Al3++3OH﹣→Al(OH)3↓
C.FeO溶于稀HCl中:O2﹣+2H+→H2O
D.铝溶解在NaOH溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.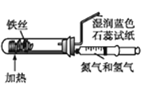 模拟工业制氨气检验产物
模拟工业制氨气检验产物
B.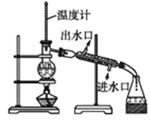 分离沸点不同的两种液体
分离沸点不同的两种液体
C.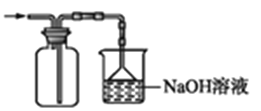 收集并吸收多余的氯气
收集并吸收多余的氯气
D. 盛放浓硝酸
盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g),在无水无氧条件下制取TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76 ℃、136 ℃,CCl4与TiCl4互溶)。下列说法正确的是
TiCl4(g)+CO2(g),在无水无氧条件下制取TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76 ℃、136 ℃,CCl4与TiCl4互溶)。下列说法正确的是
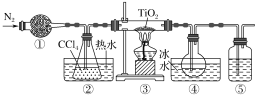
A.①、⑤分别盛装碱石灰、NaOH溶液
B.②中热水的作用是使CCl4汽化,④中冰水的作用是使TiCl4冷凝
C.③中反应结束后,先停止通N2,再停止加热
D.分离④中的液态混合物,采用的操作是分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—空气电池充放电基本原理如图所示,电池装置中间用高分子隔膜隔开,下列说法不正确的是( )
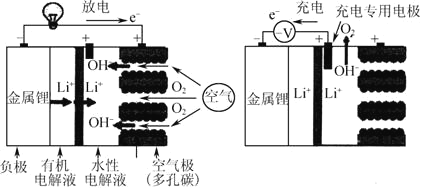
A.充电时,锂离子向阴极移动
B.充电时阴极电极反应式为Li++e- = Li
C.放电时正极电极反应式为O2+4e-+2H2O = 4OH-
D.电池装置中高分子隔膜允许水分子自由移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物)。1mol某芳香烃A充分燃烧后可得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化。
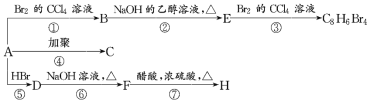
(1)A的化学式:______,A的结构简式:______。
(2)上述反应中,①是______ (填反应类型,下同)反应,⑦是______反应。
(3)写出C、D、E、H的结构简式:
C______,D______,E______,H______。
(4)写出反应D→F的化学方程式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com