
【题目】锂—空气电池充放电基本原理如图所示,电池装置中间用高分子隔膜隔开,下列说法不正确的是( )
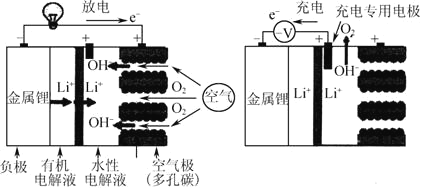
A.充电时,锂离子向阴极移动
B.充电时阴极电极反应式为Li++e- = Li
C.放电时正极电极反应式为O2+4e-+2H2O = 4OH-
D.电池装置中高分子隔膜允许水分子自由移动
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:W、X、Y、Z、T 均为短周期元素,且原子半径依次增大。请填空:
(1)W、Z是形成化合物种类最多的两种元素,写出Z的核外电子的轨道表示式______________。
(2)化合物YW3溶于水能使酚酞变红,用方程式表示酚酞变红的原因____。
(3)元素T的原子中电子占据7根轨道,则T在元素周期表____周期___族;T的化合物TY熔融时不导电,常用作砂轮与耐高温材料,由此推知,它属于____。
a离子晶体b原子晶体c分子晶体d无法判断
(4)YX3与YW3具有相同的分子空间构型,YX3属于______(填“极性”、“非极性”)分子,其中Y的化合价为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑![]()
![]() 溶液A
溶液A![]()
![]()
![]() 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是___;证明溶液A不含Fe3+的最佳试剂是___(填序号字母)。
A 酚酞溶液 B KSCN溶液
C 烧碱溶液 D KMnO4溶液
操作Ⅰ的步骤是:加热蒸发、___、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质②______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平___(填“左”或“右”)盘。
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接___;__接___。
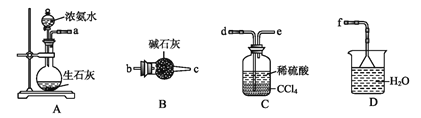
将装置C中两种液体分离开的操作名称是____。装置D的作用是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法正确的是( )
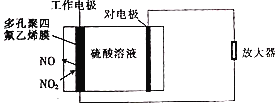
A.“对电极”是正极
B.“工作电极”上发生的电极反应为NO2+2H+-2e﹣═NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由W、X、Y、Z四种短周期元素组成化合物如图。其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍,W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是
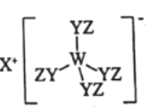
A.原子半径:W>X>Y>Z
B.常温常压下熔点:W2Y3>X2Y>Z2Y
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.1mol/L盐酸②0.1mol/L H2SO4溶液③0.1mol/LCH3COONa溶液④0.1mol/LNH4Cl溶液⑤0.1mol/L氨水,按pH由小到大顺序为_________________(填序号)
(2)等浓度的盐酸、氨水中,由水电离出的H+浓度c(H+)盐酸_________ c(H+)氨水(填“大于”“小于”或“等于”)。在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合充分反应后溶液呈中性。则反应后溶液存在的离子浓度由大到小顺序为_________,氨水的浓度a_______0.01 mol·L-1(填“>”、“<”或“=”)
(3)某同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3![]() HCO3﹣,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。
HCO3﹣,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。
①人体血液酸中毒时,可注射_____(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
②已知25℃时,![]() 水解反应的一级平衡常数
水解反应的一级平衡常数![]() ,当溶液中
,当溶液中![]() 时,溶液的pH=_________________。
时,溶液的pH=_________________。
(4)25℃时,AgCl的Ksp=1.8×10﹣10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl﹣)=_____mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中加入少量AgCl固体,则c(Cl﹣)_____(填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分地区水资源缺乏,海水淡化是永恒的话题。下列有关海水淡化的说法错误的是
A.如图制备蒸馏水方法技术成熟,但是成本太高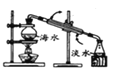
B.如图制备蒸馏水的过程,利用了清洁能源太阳能,且可分离出海水中的盐类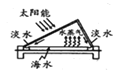
C.如图是离子交换法制备淡水,在阴阳离子交换后发生了酸碱中和反应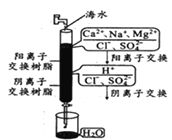
D.如图在阳离子交换过程中阳离子数目保持不变,溶液酸碱性也保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有NA个氯化氢分子的是( )
A.将1mol H2和lmol Cl2光照或点燃后的产物
B.室温下22.4L的HCl气体
C.室温下,将1mol HCl气体通入100mL水中所得的液体
D.室温下,36.5g HCl气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com