
【题目】已知:W、X、Y、Z、T 均为短周期元素,且原子半径依次增大。请填空:
(1)W、Z是形成化合物种类最多的两种元素,写出Z的核外电子的轨道表示式______________。
(2)化合物YW3溶于水能使酚酞变红,用方程式表示酚酞变红的原因____。
(3)元素T的原子中电子占据7根轨道,则T在元素周期表____周期___族;T的化合物TY熔融时不导电,常用作砂轮与耐高温材料,由此推知,它属于____。
a离子晶体b原子晶体c分子晶体d无法判断
(4)YX3与YW3具有相同的分子空间构型,YX3属于______(填“极性”、“非极性”)分子,其中Y的化合价为____。
【答案】![]() NH3+H2O NH3H2O NH4++OH- 三 IIIA b 极性 +3
NH3+H2O NH3H2O NH4++OH- 三 IIIA b 极性 +3
【解析】
(1)W、Z是形成化合物种类最多的两种元素,化合物种类最多的是烃,则W是H元素、Z是C元素;原子核外有6个电子,分别位于1s、2s、2p轨道,其原子核外电子轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)化合物YW3的水溶液能使酚酞变红,说明该物质为NH3,氨气和水反应生成一水合氨,一水合氨电离生成氢氧根离子而导致溶液呈碱性,碱遇酚酞试液变红色,故答案为:NH3+H2O NH3H2O NH4++OH-;
(3)元素T的原子中电子共占据了7个轨道,则T为Al元素,Al原子核外有3个电子层、最外层电子数是3,所以位于第三周期第IIA族;Al的化合物AIN熔融时不导电,常用作砂轮及耐高温材料,说明该物质属于原子晶体,故选b;故答案为:三;IIIA;b;
(4)NX3与NH3具有相同的分子空间构型,X为第VIIA族元素,其原子半径小于N元素,则X为F元素,氨气分子为三角锥形结构,则NF3也是三角锥形结构,该分子正负电荷重心不重合,为极性分子;NF3中N元素电负性小于F元素,所以N元素显+3价、F元素显-1价,故答案为:极性;+3。


科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A. 明矾做净水剂:Al3++ 3H2O = Al (OH)3↓+ 3H+
B. 小苏打治疗胃酸过多:CO32-+ 2H+= CO2↑+ H2O
C. 漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D. 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+ O2+2H2O= 2I2+ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1 molL—l 一元酸HR溶液中逐渐通入氨气[已知常温下NH3 H2O电离平衡常数K = l .76x 10-5], 使溶液温度和体积保持不变, 混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
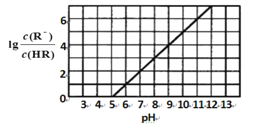
A.0. l molL—1HR 溶液的pH为5
B.HR为弱酸,常温时随着氨气的通入,c(R—)/[c(OH—).c(HR)] 逐渐增大
C.当通入0.1 mol NH3时,c(NH4+ > c(R—)
D.当c(R— )=c(HR)时 溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡是一种无色有强烈的刺激性气味的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂。工业上常用氯气与金属锡或 SnCl2 来制得。某化学兴趣小组把干燥氯气通入熔融 SnCl2 2H2O中制取无水SnCl4有如图所示的相关装置:
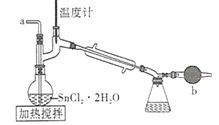
(1)盛装SnCl4的容器应贴上的安全警示标签是____________(填序号)。

(2)装置b的作用是______________________ 。
(3)为避免 SnCl4 水解,通Cl2 前应先除 SnCl2 的结晶水,其操作是_____________,在潮湿空气中 SnCl4 水解产生白色烟雾, 其化学方程式为 ________________ 。
(4)该学习小组最终制得的SnCl4 呈黄色,可能的原因是 ______________________,如果要除去黄色得到无色产品,你的做法是 ________________________。
(5)可以通过测定剩余SnCl4 的量来计算该次实验的产率, 方法是让残留的SnCl4 与足量硫酸铁铣反应,其中Fe3+被Sn2+还原为Fe2+。 然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用 K2Cr2O7 标准溶液滴定生成的Fe2+过程中的离子方程式为
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是____
③若实验前称取 22.6g SnC12H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL 溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7标准溶20.00mL, 则 SnCl4的产率最大值为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
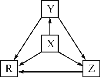
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.Fe(OH)3溶于稀 H2SO4 中:H++OH﹣→H2O
B.氨水滴入AlCl3溶液中:Al3++3OH﹣→Al(OH)3↓
C.FeO溶于稀HCl中:O2﹣+2H+→H2O
D.铝溶解在NaOH溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—空气电池充放电基本原理如图所示,电池装置中间用高分子隔膜隔开,下列说法不正确的是( )
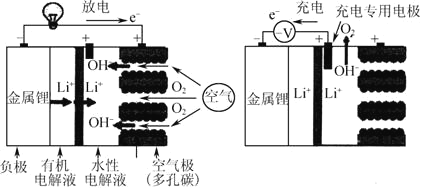
A.充电时,锂离子向阴极移动
B.充电时阴极电极反应式为Li++e- = Li
C.放电时正极电极反应式为O2+4e-+2H2O = 4OH-
D.电池装置中高分子隔膜允许水分子自由移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com