
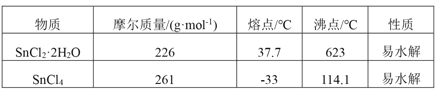
【题目】四氯化锡是一种无色有强烈的刺激性气味的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂。工业上常用氯气与金属锡或 SnCl2 来制得。某化学兴趣小组把干燥氯气通入熔融 SnCl2 2H2O中制取无水SnCl4有如图所示的相关装置:
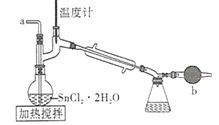
(1)盛装SnCl4的容器应贴上的安全警示标签是____________(填序号)。

(2)装置b的作用是______________________ 。
(3)为避免 SnCl4 水解,通Cl2 前应先除 SnCl2 的结晶水,其操作是_____________,在潮湿空气中 SnCl4 水解产生白色烟雾, 其化学方程式为 ________________ 。
(4)该学习小组最终制得的SnCl4 呈黄色,可能的原因是 ______________________,如果要除去黄色得到无色产品,你的做法是 ________________________。
(5)可以通过测定剩余SnCl4 的量来计算该次实验的产率, 方法是让残留的SnCl4 与足量硫酸铁铣反应,其中Fe3+被Sn2+还原为Fe2+。 然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用 K2Cr2O7 标准溶液滴定生成的Fe2+过程中的离子方程式为
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是____
③若实验前称取 22.6g SnC12H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL 溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7标准溶20.00mL, 则 SnCl4的产率最大值为__________ 。
【答案】AC 除去尾气中的氯气,防止空气污染 防止外界水蒸气进入锥形瓶而使产物水解 从a口通入氯化氢气体,同时加热圆底烧瓶 SnCl4+4H2O=Sn(OH)4+4HCl(或SnCl4+2H2O=SnO2+4HCl) SnCl4溶有未反应的氯气 加入锡粒(或加热、向SnCl4中通入氮气等,合理给分) 1 6 14H+ 2 6 7H2O 滴入最后一滴标准液,溶液由无色变为浅紫色,且半分钟内不褪色 94%
【解析】
(1)根据题目中“四氯化锡是一种无色有强烈的刺激性液体,有腐蚀性”分析;
(2)根据仪器特点和作用分析;
(3)除去SnCl22H2O中结晶水,从抑制的SnCl2水解分析;SnCl4水解产生白色烟雾HCl和Sn(OH)4,据此书写;
(4)SnCl4呈黄色可能含有氯气,通入惰性气体赶走氯气或将氯气反应为产品均可;
(5)①反应条件是酸性环境,根据得失电子守恒和质量守恒可得;
②K2Cr2O7标准溶液滴定完生成的Fe2+时,开始氧化二苯胺磺酸钠,得其氧化态,据此可得;
③根据关系式:![]() ,则n(SnCl22H2O)=3n(K2Cr2O7),
,则n(SnCl22H2O)=3n(K2Cr2O7),
则22.6g样品中![]() ,据此计算。
,据此计算。
(1)已知:四氯化锡是一种无色有强烈的刺激性液体,有腐蚀性,则盛装SnCl4的容器应贴上的安全警示标签是腐蚀品,有刺激性,选AC;
故答案为:AC;
(2)装置b为干燥管,实验中氯气有毒不能直接排放,产物遇水易水解,装置应防止空气中的水蒸气进入,故干燥管的作用是:除去尾气中的氯气,防止空气污染,防止外界水蒸气进入锥形瓶而使产物水解;
故答案为:除去尾气中的氯气,防止空气污染,防止外界水蒸气进入锥形瓶而使产物水解;
(3)SnCl2水解:![]() ,为除去其结晶水,应在HCl的热气流中干燥,操作为:从a口通入氯化氢气体,同时加热圆底烧瓶;SnCl4水解产生白色烟雾HCl和Sn(OH)4,反应为:
,为除去其结晶水,应在HCl的热气流中干燥,操作为:从a口通入氯化氢气体,同时加热圆底烧瓶;SnCl4水解产生白色烟雾HCl和Sn(OH)4,反应为:![]() ;
;
故答案为:从a口通入氯化氢气体,同时加热圆底烧瓶; ![]() ;
;
(4)SnCl4呈黄色可能含有未反应的氯气,使其呈黄色;通入惰性气体赶走氯气或将氯气反应为产品均可,故加入锡粒(或加热、向SnCl4中通入氮气等)可除去黄色得到无色产品;
故答案为:SnCl4溶有未反应的氯气;加入锡粒(或加热、向SnCl4中通入氮气等);
(5)①在硫酸和磷酸混合条件下,K2Cr2O7标准溶液滴定生成的Fe2+。过程中的离子方程式为:![]() ;
;
故答案为:1;6;14H+;2;6;7H2O;
②K2Cr2O7标准溶液滴定完生成的Fe2+时,开始氧化二苯胺磺酸钠,得其氧化态,则当滴入最后一滴指示剂,溶液由无色变为浅紫色,且半分钟内不褪色,达到滴定终点;
故答案为:滴入最后一滴标准液,溶液由无色变为浅紫色,且半分钟内不褪色;
③根据关系式:![]() ,则n(SnCl22H2O)=3n(K2Cr2O7),
,则n(SnCl22H2O)=3n(K2Cr2O7),
则22.6g样品中![]() ,
,
则SnCl4的产率为![]() ;
;
故答案为:94%。
氧化还原方程式的配平根据得失电子守恒和质量守恒可得。


科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成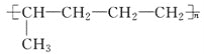 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 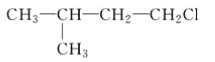 B.
B. 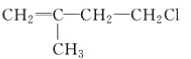 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 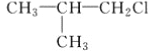
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中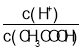 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() >1
>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
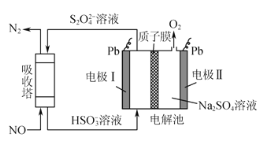
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
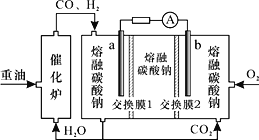
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:W、X、Y、Z、T 均为短周期元素,且原子半径依次增大。请填空:
(1)W、Z是形成化合物种类最多的两种元素,写出Z的核外电子的轨道表示式______________。
(2)化合物YW3溶于水能使酚酞变红,用方程式表示酚酞变红的原因____。
(3)元素T的原子中电子占据7根轨道,则T在元素周期表____周期___族;T的化合物TY熔融时不导电,常用作砂轮与耐高温材料,由此推知,它属于____。
a离子晶体b原子晶体c分子晶体d无法判断
(4)YX3与YW3具有相同的分子空间构型,YX3属于______(填“极性”、“非极性”)分子,其中Y的化合价为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3 mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是( )
A.25 ℃时,0.01 mol·L-1 Na2S水溶液中,pC(H+)+pC(OH-)=14
B.用0.01 mol·L-1的NaOH溶液滴定某浓度的盐酸,滴定过程中pC(OH-)逐渐增大
C.某温度下,A2B难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B2-)=10
D.向0.01 mol·L-1的Ca(HCO3)2溶液中逐渐滴加烧碱溶液,滴加过程中pC(Ca2+)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
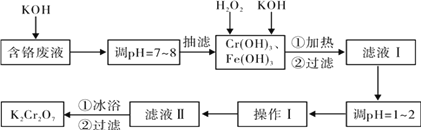
已知:①Cr(OH)3 + OH- = CrO2- + 2H2O; ②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。
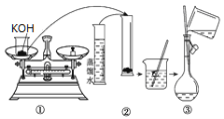
①请你观察图示判断,其中不正确的操作有(填序号)________;
②其中配制250 mL溶液的体积容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是_________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL 淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_________。
②滴定终点的现象为_________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法正确的是( )
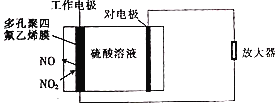
A.“对电极”是正极
B.“工作电极”上发生的电极反应为NO2+2H+-2e﹣═NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com