
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中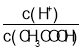 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() >1
>1
【答案】D
【解析】
A.向0.1mol/L CH3COOH溶液中加入少量水促进醋酸电离,氢离子物质的量增大,醋酸物质的量减少,溶液中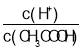 增大,故A错误;
增大,故A错误;
B.将CH3COONa溶液从20℃升温至30℃,促进CH3COONa的水解,c(CH3COO-)减小,氢氧根离子浓度增大,则溶液中![]() 减小,故B错误;
减小,故B错误;
C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(Cl-)得到c(NH4+)=c(Cl-),![]() =1,故C错误;
=1,故C错误;
D.相同条件下,AgCl的溶解度大于AgBr,则AgCl、AgBr的饱和溶液中c(Cl-)>c(Br-),所以向AgCl、AgBr的饱和溶液中加入少量AgNO3,先生成AgBr沉淀,所以溶液中仍然存在c(Cl-)>c(Br-),则溶液中![]() >1,故D正确;
>1,故D正确;
故答案为D。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下,将pH=4的盐酸1mL稀释至100 mL后,pH等于6
B.常温下,pH均为3的醋酸和硝酸溶液,醋酸的浓度大于硝酸的浓度
C.常温下,pH为1的硝酸溶液中加入等体积pH为13氢氧化钡溶液恰好完全中和
D.若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下:

下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.元素乙的简单气态氢化物的稳定性强于CH4
C.原子半径比较:甲>乙>Si
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M( )是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
)是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
A.所有原子不可能处于同一平面
B.可以发生加聚反应和缩聚反应
C.与 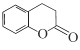 互为同分异构体.
互为同分异构体.
D.1 mol M最多能与1mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
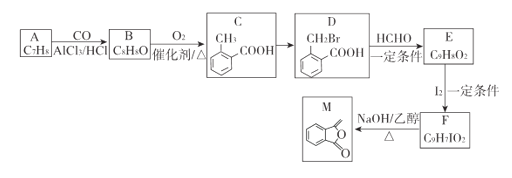
已知:R1CH2Br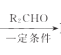 R1CH=CHR2
R1CH=CHR2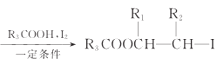
回答下列问题:
(1)A的结构简式为_______;B中官能团的名称为_______;C的化学名称为_________。
(2)由C生成D所需的试剂和条件为_______,该反应类型为____________.
(3)由F生成M的化学方程式为__________________________________。
(4)Q为M的同分异构体,满足下列条件的Q的结构有________种(不含立体异构),任写出其中一.种核磁共振氢谱中有4组吸收峰的结构简式_________________。
①除苯环外无其他环状结构
②能发生水解反应和银镜反应
(5)参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备聚2-丁烯的合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
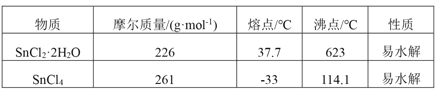
【题目】四氯化锡是一种无色有强烈的刺激性气味的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂。工业上常用氯气与金属锡或 SnCl2 来制得。某化学兴趣小组把干燥氯气通入熔融 SnCl2 2H2O中制取无水SnCl4有如图所示的相关装置:
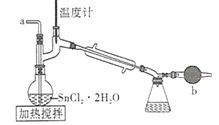
(1)盛装SnCl4的容器应贴上的安全警示标签是____________(填序号)。

(2)装置b的作用是______________________ 。
(3)为避免 SnCl4 水解,通Cl2 前应先除 SnCl2 的结晶水,其操作是_____________,在潮湿空气中 SnCl4 水解产生白色烟雾, 其化学方程式为 ________________ 。
(4)该学习小组最终制得的SnCl4 呈黄色,可能的原因是 ______________________,如果要除去黄色得到无色产品,你的做法是 ________________________。
(5)可以通过测定剩余SnCl4 的量来计算该次实验的产率, 方法是让残留的SnCl4 与足量硫酸铁铣反应,其中Fe3+被Sn2+还原为Fe2+。 然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用 K2Cr2O7 标准溶液滴定生成的Fe2+过程中的离子方程式为
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是____
③若实验前称取 22.6g SnC12H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL 溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7标准溶20.00mL, 则 SnCl4的产率最大值为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.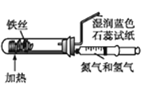 模拟工业制氨气检验产物
模拟工业制氨气检验产物
B.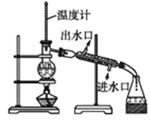 分离沸点不同的两种液体
分离沸点不同的两种液体
C.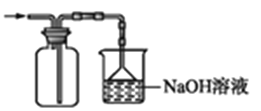 收集并吸收多余的氯气
收集并吸收多余的氯气
D. 盛放浓硝酸
盛放浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com