
【题目】下列说法不正确的是( )
A.常温下,将pH=4的盐酸1mL稀释至100 mL后,pH等于6
B.常温下,pH均为3的醋酸和硝酸溶液,醋酸的浓度大于硝酸的浓度
C.常温下,pH为1的硝酸溶液中加入等体积pH为13氢氧化钡溶液恰好完全中和
D.若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
【答案】D
【解析】
A. HCl为强酸,完全电离,稀释过程中溶质的物质的量不变,因此有稀释后c(H+)=![]() =10-6mol·L-1,即pH=6,故A说法正确;
=10-6mol·L-1,即pH=6,故A说法正确;
B. 醋酸为弱酸,部分电离,硝酸为强酸,完全电离,因此相同pH时,醋酸的物质的量浓度大于硝酸的物质的量浓度,故B说法正确;
C. 常温下,pH=1的硝酸溶液中c(H+)=10-1mol·L-1,pH=13的氢氧化钡溶液中c(OH-)=10-1mol·L-1,等体积混合后,H+和OH-物质的量相等,两者恰好完全反应,故C说法正确;
D. 如果HA为强酸,则V1=V2,如果HA为弱酸,HA的浓度远远大于氢氧化钠的浓度,则V1>V2,故D说法错误;
答案:D。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
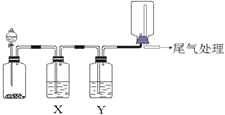
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为t℃时,在体积为10 L的真空容器中通入1.0 mol H2和1.0mol I2(g),20 min后,反应达到平衡,此时测得c(I2)=0.02mol·L-1。涉及的反应可以用下面的两个化学方程式表示:①H2(g)+I2(g)![]() 2HI(g)②2H2(g)+2I2(g)
2HI(g)②2H2(g)+2I2(g)![]() 4HI(g),下列说法正确的是( )
4HI(g),下列说法正确的是( )
A.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
B.氢气在两个反应方程式中的转化率不同
C.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
D.第二个反应中,增大压强平衡向生成HI的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究化学反应速率,某小组同学做了如下实验:在两支试管中分别加入3 mL稀盐酸(均足量)(查阅资料获知,只有浓度小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3gNaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
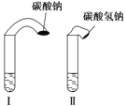
(1)试管中产生的现象为_______________________________________;
(2)试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他推测:NaHCO3溶液和稀盐酸反应为吸热反应,而Na2CO3溶液和稀盐酸反应为放热反应。甲得出的结论是否正确________(填“正确”或“不正确”),如不正确,请说明原因:________。
(4)另一小组同学设计实验测定碳酸钠粉末和稀盐酸反应的速率,按下列实验步骤完成实验:按下图所示安装装置,加入碳酸钠粉末,然后快速加入40mL1mol·L-1的稀盐酸,测量收集10mLCO2所用的时间。
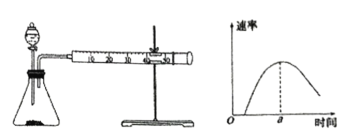
①安装装置后首先要进行的操作是_______________________。
②根据实验,该小组同学绘制产生CO2的速率如图所示,a点前反应速率逐渐增大的原因是__________;a点后速率逐渐下降的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可采用CH3OH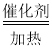 CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图,下列说法正确的是
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。下图为计算机模拟的各步反应的能量变化示意图,下列说法正确的是
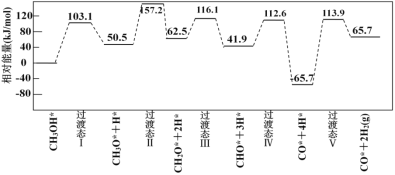
A.CH3OH脱氢反应的第一步历程为CH3OH* =CH3*+OH*
B.该历程中最大活化能E正=179.6 kJmol-1
C.该历程中,放热最多的步骤的化学方程式为CHO*+ 4H* =CO*+2H2(g)
D.CH3OH* = CO*+2H2(g) △H=65.7 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L (NH4)2SO4,⑤0.1 mol/L氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是____________________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)上述溶液中c(NH4+)最小的是_________(填序号)。
(4)常温下,0.1 mol/ L氨水溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(OH—) B.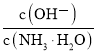
C.c(H+)·c(OH-) D.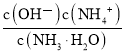
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
2NH3△H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理。如图所示,下列说法不正确的是
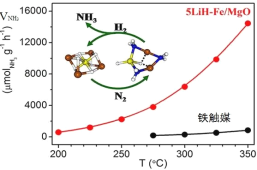
A.转化过程中有非极性键断裂与形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.低温下合成氨,能提高原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成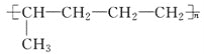 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 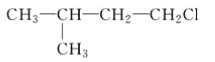 B.
B. 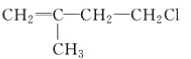 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 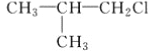
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中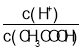 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() >1
>1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com