
【题目】温度为t℃时,在体积为10 L的真空容器中通入1.0 mol H2和1.0mol I2(g),20 min后,反应达到平衡,此时测得c(I2)=0.02mol·L-1。涉及的反应可以用下面的两个化学方程式表示:①H2(g)+I2(g)![]() 2HI(g)②2H2(g)+2I2(g)
2HI(g)②2H2(g)+2I2(g)![]() 4HI(g),下列说法正确的是( )
4HI(g),下列说法正确的是( )
A.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
B.氢气在两个反应方程式中的转化率不同
C.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
D.第二个反应中,增大压强平衡向生成HI的方向移动
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
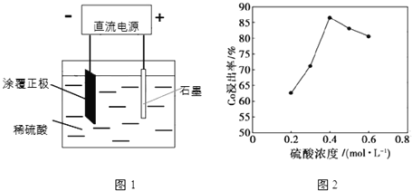
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g)![]() 2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)![]() 2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2和H2的转化率不相等
D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法错误的是
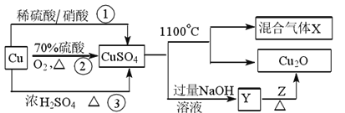
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.Z可以是葡萄糖
C.混合气体中一定有O2,1 mol CuSO4完全反应生成O2为0.5 mol
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol·L1 NaOH溶液滴定20.00 mL 0.1000 mol·L1的H3A溶液的滴定曲线如图所示。己知H3A的pKa1、pKa2、pKa3分别为2、7和12(pKa=-lgKa),下列说法正确的是
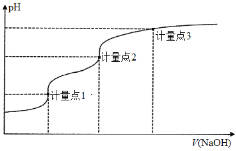
A.滴定前溶液pH值约为3
B.计量点1时,可以用甲基橙作为指示剂
C.到达计量点2时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达计量点3时,微热溶液,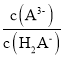 会增大
会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下,将pH=4的盐酸1mL稀释至100 mL后,pH等于6
B.常温下,pH均为3的醋酸和硝酸溶液,醋酸的浓度大于硝酸的浓度
C.常温下,pH为1的硝酸溶液中加入等体积pH为13氢氧化钡溶液恰好完全中和
D.若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下:

下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.元素乙的简单气态氢化物的稳定性强于CH4
C.原子半径比较:甲>乙>Si
D.推测乙可以用作半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com