
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法错误的是
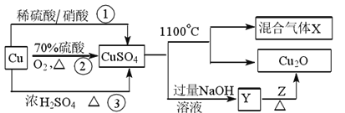
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.Z可以是葡萄糖
C.混合气体中一定有O2,1 mol CuSO4完全反应生成O2为0.5 mol
D.相对于途径①、③,途径②更好地体现了绿色化学思想
【答案】C
【解析】
A..如途径①用混酸,Cu与混酸反应,3Cu+3H2SO4+2HNO3(稀)=3CuSO4+2NO↑+4H2O,离子反应为:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O,从方程式知,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,所以硝酸为2mol时,硫酸为3mol,用混酸中H2SO4与HNO3物质的量之比最好为3:2,故A正确;
B.葡萄糖与氢氧化铜反应的方程式为C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Z可为葡萄糖,故B正确;
C.根据2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑知,1molCuSO4在1100℃所得混合气体X中,O2为0.5mol,但是,由于存在三氧硫的分解平衡,无法确定产物中氧气的物质的量是多少,故C错误;
Cu2O+SO2↑+SO3↑+O2↑知,1molCuSO4在1100℃所得混合气体X中,O2为0.5mol,但是,由于存在三氧硫的分解平衡,无法确定产物中氧气的物质的量是多少,故C错误;
D..相对于途径①、③,途径②的优点是:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生。故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g)+2B(g)![]() 2C(g)达到平衡的标志是( )
2C(g)达到平衡的标志是( )
A.C的生成速率与C分解的速率相等
B.单位时间内生成nmol A,同时生成2nmol B
C.单位时间内消耗nmol A,同时生成2nmol C
D.B的生成速率与C分解的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物他莫肯芬(Tamoxifen)的一种合成路线如图所示:

已知:![]() +HBr
+HBr![]() +RBr
+RBr

回答下列问题。
(1)A+B→C的反应类型为__;C中官能团有醚键、__(填名称)。
(2)CH3CH2I的名称为__。
(3)反应D→E的化学方程式为__。
(4)Tamoxifen的结构简式为__。
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为__、__(写2种)。
(6)设计用 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为t℃时,在体积为10 L的真空容器中通入1.0 mol H2和1.0mol I2(g),20 min后,反应达到平衡,此时测得c(I2)=0.02mol·L-1。涉及的反应可以用下面的两个化学方程式表示:①H2(g)+I2(g)![]() 2HI(g)②2H2(g)+2I2(g)
2HI(g)②2H2(g)+2I2(g)![]() 4HI(g),下列说法正确的是( )
4HI(g),下列说法正确的是( )
A.两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同
B.氢气在两个反应方程式中的转化率不同
C.反应速率用HI表示时,v(HI)=0.008 mol·L-1·min-1
D.第二个反应中,增大压强平衡向生成HI的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化,下列说法正确的是( )
CH3OH(g)+H2O(g)。将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化,下列说法正确的是( )

A.反应开始至a点时v(H2)=1mol·L-1·S-1
B.若曲线I对应的条件改变是升高温度,则该反应△H>0
C.曲线II对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2mol·L-1<c(CH3OH)<8/3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究化学反应速率,某小组同学做了如下实验:在两支试管中分别加入3 mL稀盐酸(均足量)(查阅资料获知,只有浓度小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3gNaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
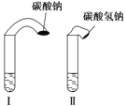
(1)试管中产生的现象为_______________________________________;
(2)试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他推测:NaHCO3溶液和稀盐酸反应为吸热反应,而Na2CO3溶液和稀盐酸反应为放热反应。甲得出的结论是否正确________(填“正确”或“不正确”),如不正确,请说明原因:________。
(4)另一小组同学设计实验测定碳酸钠粉末和稀盐酸反应的速率,按下列实验步骤完成实验:按下图所示安装装置,加入碳酸钠粉末,然后快速加入40mL1mol·L-1的稀盐酸,测量收集10mLCO2所用的时间。
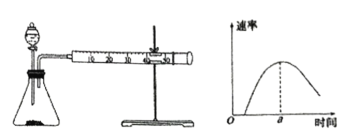
①安装装置后首先要进行的操作是_______________________。
②根据实验,该小组同学绘制产生CO2的速率如图所示,a点前反应速率逐渐增大的原因是__________;a点后速率逐渐下降的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L (NH4)2SO4,⑤0.1 mol/L氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是____________________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)上述溶液中c(NH4+)最小的是_________(填序号)。
(4)常温下,0.1 mol/ L氨水溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(OH—) B.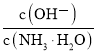
C.c(H+)·c(OH-) D.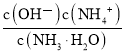
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A.![]() 、
、![]() 与
与![]() 分子中均含有
分子中均含有![]() 键,且
键,且![]() 键为轴对称
键为轴对称
B.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
C.酸性:![]() ,因为
,因为![]() 中非羟基氧原子数大于次氯酸中非羟基氧原子数
中非羟基氧原子数大于次氯酸中非羟基氧原子数
D.水分子中化学键的极性的向量和等于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com