
【题目】为探究化学反应速率,某小组同学做了如下实验:在两支试管中分别加入3 mL稀盐酸(均足量)(查阅资料获知,只有浓度小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3gNaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
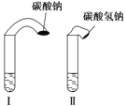
(1)试管中产生的现象为_______________________________________;
(2)试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他推测:NaHCO3溶液和稀盐酸反应为吸热反应,而Na2CO3溶液和稀盐酸反应为放热反应。甲得出的结论是否正确________(填“正确”或“不正确”),如不正确,请说明原因:________。
(4)另一小组同学设计实验测定碳酸钠粉末和稀盐酸反应的速率,按下列实验步骤完成实验:按下图所示安装装置,加入碳酸钠粉末,然后快速加入40mL1mol·L-1的稀盐酸,测量收集10mLCO2所用的时间。
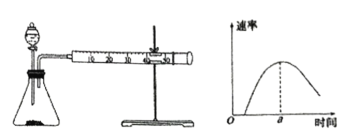
①安装装置后首先要进行的操作是_______________________。
②根据实验,该小组同学绘制产生CO2的速率如图所示,a点前反应速率逐渐增大的原因是__________;a点后速率逐渐下降的原因是_______________________。
【答案】两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多 42:53 不正确 NaHCO3反应激烈,产生CO2速度快,带出的热量快,仅根据手感来确定是不科学的,而且反应热与物质的状态有关 检查装置气密性 反应放热,加快化学反应速率 盐酸的浓度逐渐降低,反应速率减小
【解析】
⑴固体加入到盐酸中,迅速反应,NaHCO3与盐酸反应速率快。
⑵盐酸过量,0.3gNaHCO3和Na2CO3粉末物质的量之比,即为气体的体积之比。
⑶由于碳酸氢钠反应激烈,产生的二氧化碳速率快,带出的热量快,不能根据手感来判断,而且反应热与物质的状态有关。
⑷①安装发生装置后首先要进行的操作是检查装置气密性;②根据实验,该小组同学绘制产生CO2的速率如图所示,开始速率小,后来速率增大,主要由于反应是放热反应,温度升高影响速率,后来a点后速率逐渐下降的主要是盐酸的浓度降低。
⑴固体加入到盐酸中,迅速反应,因此试管中产生的现象为两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;故答案为:两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多。
⑵盐酸过量,0.3gNaHCO3和Na2CO3粉末物质的量之比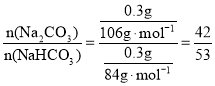 ,由于盐酸过量,因此试管中气球大小(包含试管)体积之比等于两者物质的物质的量之比即Ⅰ∶Ⅱ=42:53;故答案为:42:53。
,由于盐酸过量,因此试管中气球大小(包含试管)体积之比等于两者物质的物质的量之比即Ⅰ∶Ⅱ=42:53;故答案为:42:53。
⑶由于碳酸氢钠与盐酸反应比碳酸钠与盐酸反应激烈,产生的二氧化碳速率快,带出的热量快,不能根据手感来判断,而且反应热与物质的状态有关,因此甲得出的结论是不正确,主要原因是NaHCO3反应激烈,产生CO2速度快,带出的热量快,仅根据手感来确定是不科学的,而且反应热与物质的状态有关;故答案为:NaHCO3反应激烈,产生CO2速度快,带出的热量快,仅根据手感来确定是不科学的,而且反应热与物质的状态有关。
⑷①气体发生装置并收集气体,则安装装置后首先要进行的操作是检查装置气密性;故答案为:检查装置气密性。
②根据实验,该小组同学绘制产生CO2的速率如图所示,开始速率小,后来速率增大,虽然浓度减小,但由于反应是放热反应,温度升高影响速率大,因此a点前反应速率逐渐增大的原因是反应放热,加快化学反应速率;后来温度虽然升高,但浓度减小且影响大,因此a点后速率逐渐下降的原因是盐酸的浓度逐渐降低,反应速率减小;故答案为:反应放热,加快化学反应速率;盐酸的浓度逐渐降低,反应速率减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:
A  B
B 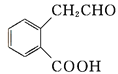 C
C 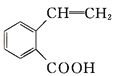 D
D 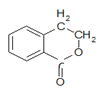
(1)A的分子式是______,B中的含氧官能团名称是______、________。
(2)A→B的反应类型是______;A—D中互为同分异构体的是______ (填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g)![]() 2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)![]() 2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示(假设恰好完全反应)。下列说法错误的是
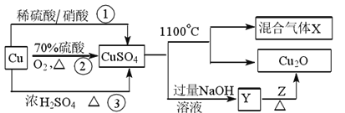
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.Z可以是葡萄糖
C.混合气体中一定有O2,1 mol CuSO4完全反应生成O2为0.5 mol
D.相对于途径①、③,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol·L1 NaOH溶液滴定20.00 mL 0.1000 mol·L1的H3A溶液的滴定曲线如图所示。己知H3A的pKa1、pKa2、pKa3分别为2、7和12(pKa=-lgKa),下列说法正确的是
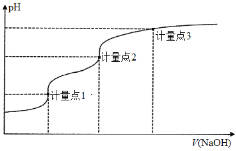
A.滴定前溶液pH值约为3
B.计量点1时,可以用甲基橙作为指示剂
C.到达计量点2时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达计量点3时,微热溶液,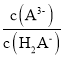 会增大
会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
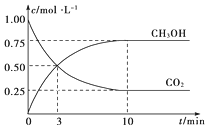
A.欲增大平衡状态时![]() 的比值,可采用升高温度的方法
的比值,可采用升高温度的方法
B.3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.常温下,将pH=4的盐酸1mL稀释至100 mL后,pH等于6
B.常温下,pH均为3的醋酸和硝酸溶液,醋酸的浓度大于硝酸的浓度
C.常温下,pH为1的硝酸溶液中加入等体积pH为13氢氧化钡溶液恰好完全中和
D.若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 所有的原子都含有质子、中子和电子三种基本构成微粒
B. 宇宙大爆炸产生了氢、氦、锂元素
C. ![]() 左图的原子模型是玻尔提出的
左图的原子模型是玻尔提出的
D.  模型中的小黑点表示电子在原子核外出现的概率密度的形象描述
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com