
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
科目:高中化学 来源: 题型:
【题目】为探究化学反应速率,某小组同学做了如下实验:在两支试管中分别加入3 mL稀盐酸(均足量)(查阅资料获知,只有浓度小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3gNaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
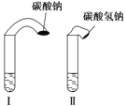
(1)试管中产生的现象为_______________________________________;
(2)试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他推测:NaHCO3溶液和稀盐酸反应为吸热反应,而Na2CO3溶液和稀盐酸反应为放热反应。甲得出的结论是否正确________(填“正确”或“不正确”),如不正确,请说明原因:________。
(4)另一小组同学设计实验测定碳酸钠粉末和稀盐酸反应的速率,按下列实验步骤完成实验:按下图所示安装装置,加入碳酸钠粉末,然后快速加入40mL1mol·L-1的稀盐酸,测量收集10mLCO2所用的时间。
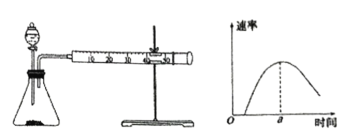
①安装装置后首先要进行的操作是_______________________。
②根据实验,该小组同学绘制产生CO2的速率如图所示,a点前反应速率逐渐增大的原因是__________;a点后速率逐渐下降的原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成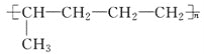 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 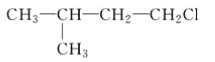 B.
B. 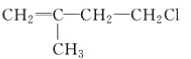 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 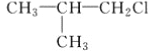
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A.![]() 、
、![]() 与
与![]() 分子中均含有
分子中均含有![]() 键,且
键,且![]() 键为轴对称
键为轴对称
B.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
C.酸性:![]() ,因为
,因为![]() 中非羟基氧原子数大于次氯酸中非羟基氧原子数
中非羟基氧原子数大于次氯酸中非羟基氧原子数
D.水分子中化学键的极性的向量和等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B |
|
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)![]() 原子的核外电子排布式:___________________。
原子的核外电子排布式:___________________。
(2)![]() 元素在元素周期表中的位置________;离子半径:
元素在元素周期表中的位置________;离子半径:![]() ____
____![]() (填“大于”或“小于”)
(填“大于”或“小于”)
(3)![]() 原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
(4)![]() 的结构示意图是________________。
的结构示意图是________________。
(5)![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的最高价氧化物对应的水化物反应的化学方程式为________,与
的最高价氧化物对应的水化物反应的化学方程式为________,与![]() 最高价氧化物对应的水化物反应的化学方程式为________________。
最高价氧化物对应的水化物反应的化学方程式为________________。
(6)举一实例说明![]() 元素的非金属性比
元素的非金属性比![]() 元素的强_______________
元素的强_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:

回答下列问题:
(1)“煅烧”可在_______(填仪器名称)中进行,主要反应的化学方程式为________;除“粉碎”外,还可以加快“煅烧”速率的措施有_________(只答一点即可)。
(2)实验室制取氧气。

①氧气的发生装置可以选择上图中的__________(填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→________(填小写字母);检验氧气已收集满的操作和现象为________。
(3)“酸浸”时,温度不能过高的原因为_______;若用盐酸代替双氧水、H2SO4的不足之处为____________;该步骤不能使用陶瓷容器的原因为___________________。
(4)“氧化”反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol/L的CH3COOH溶液中加少量水,溶液中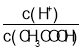 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() >1
>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
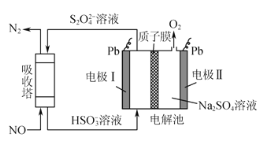
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
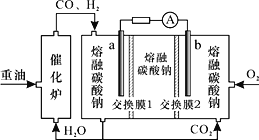
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
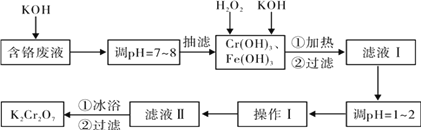
已知:①Cr(OH)3 + OH- = CrO2- + 2H2O; ②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。
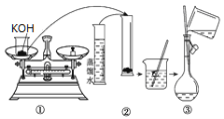
①请你观察图示判断,其中不正确的操作有(填序号)________;
②其中配制250 mL溶液的体积容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是_________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL 淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_________。
②滴定终点的现象为_________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com