
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B |
|
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)![]() 原子的核外电子排布式:___________________。
原子的核外电子排布式:___________________。
(2)![]() 元素在元素周期表中的位置________;离子半径:
元素在元素周期表中的位置________;离子半径:![]() ____
____![]() (填“大于”或“小于”)
(填“大于”或“小于”)
(3)![]() 原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
原子的电子排布图是______,能量最高的电子为______轨道上的电子,其轨道呈______形。
(4)![]() 的结构示意图是________________。
的结构示意图是________________。
(5)![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的最高价氧化物对应的水化物反应的化学方程式为________,与
的最高价氧化物对应的水化物反应的化学方程式为________,与![]() 最高价氧化物对应的水化物反应的化学方程式为________________。
最高价氧化物对应的水化物反应的化学方程式为________________。
(6)举一实例说明![]() 元素的非金属性比
元素的非金属性比![]() 元素的强_______________
元素的强_______________
【答案】![]() 第三周期第IIIA族 小于
第三周期第IIIA族 小于 ![]() 2p 哑铃
2p 哑铃 
![]()
![]() 高氯酸的酸性强于硝酸
高氯酸的酸性强于硝酸
【解析】
根据表格分析,短周期元素半径最大的原子是钠,则A是Na,![]() 与
与![]() 同周期,其最高价氧化物的水化物呈两性,则B是Al,C元素的气态氢化物极易溶于水,可用作制冷剂,则C是N,D质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D是Cl。
同周期,其最高价氧化物的水化物呈两性,则B是Al,C元素的气态氢化物极易溶于水,可用作制冷剂,则C是N,D质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D是Cl。
(1)![]() 原子(11号)的核外电子排布式:
原子(11号)的核外电子排布式:![]() ;
;
(2)![]() 元素是Al,位于元素周期表第三周期第IIIA族;离子的电子结构相同,则序数越大,质子与电子的吸引力越强,半径越小,故离子半径:
元素是Al,位于元素周期表第三周期第IIIA族;离子的电子结构相同,则序数越大,质子与电子的吸引力越强,半径越小,故离子半径:![]() 小于
小于![]() ;
;
(3)![]() 原子(N)的电子排布图是:
原子(N)的电子排布图是:![]() ,电子的排布遵守能量最低原理,故2p轨道上的电子能量最高,s级的形状是球形,p能级的形状是哑铃形;
,电子的排布遵守能量最低原理,故2p轨道上的电子能量最高,s级的形状是球形,p能级的形状是哑铃形;
(4)![]() (Cl)的结构示意图是:
(Cl)的结构示意图是: ;
;
(5)![]() 具有两性,能溶于强酸和强碱;
具有两性,能溶于强酸和强碱;![]() 的最高价氧化物对应的水化物(
的最高价氧化物对应的水化物(![]() )与
)与![]() 的最高价氧化物对应的水化物(
的最高价氧化物对应的水化物(![]() )反应的化学方程式为:
)反应的化学方程式为:![]() ;
;![]()
![]() 最高价氧化物对应的水化物(
最高价氧化物对应的水化物(![]() )反应的化学方程式为
)反应的化学方程式为![]() ;
;
(6)元素的非金属性越强,则最高价氧化物对应的水化物酸性越强,故高氯酸的酸性强于硝酸,能说明氯的非金属性强于氮。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】用0.1000 mol·L1 NaOH溶液滴定20.00 mL 0.1000 mol·L1的H3A溶液的滴定曲线如图所示。己知H3A的pKa1、pKa2、pKa3分别为2、7和12(pKa=-lgKa),下列说法正确的是
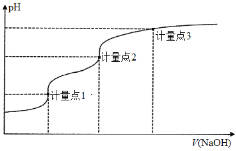
A.滴定前溶液pH值约为3
B.计量点1时,可以用甲基橙作为指示剂
C.到达计量点2时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达计量点3时,微热溶液,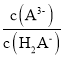 会增大
会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH ![]() CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(![]() )为___________ (用π含的式子表示),(提示原子空间利用率=
)为___________ (用π含的式子表示),(提示原子空间利用率=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下:

下列说法不正确的是
A.元素甲位于现行元素周期表第四周期第ⅢA族
B.元素乙的简单气态氢化物的稳定性强于CH4
C.原子半径比较:甲>乙>Si
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M( )是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
)是合成一种抗癌药物的重要中间体,下列关于M的说法正确的是
A.所有原子不可能处于同一平面
B.可以发生加聚反应和缩聚反应
C.与 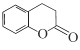 互为同分异构体.
互为同分异构体.
D.1 mol M最多能与1mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制备M的一种合成路线如下:
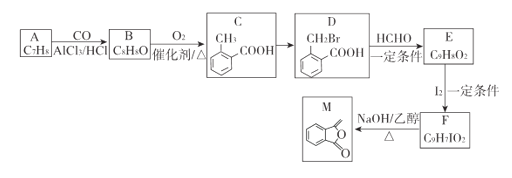
已知:R1CH2Br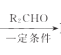 R1CH=CHR2
R1CH=CHR2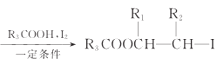
回答下列问题:
(1)A的结构简式为_______;B中官能团的名称为_______;C的化学名称为_________。
(2)由C生成D所需的试剂和条件为_______,该反应类型为____________.
(3)由F生成M的化学方程式为__________________________________。
(4)Q为M的同分异构体,满足下列条件的Q的结构有________种(不含立体异构),任写出其中一.种核磁共振氢谱中有4组吸收峰的结构简式_________________。
①除苯环外无其他环状结构
②能发生水解反应和银镜反应
(5)参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备聚2-丁烯的合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个碳原子结合成的6种有机物(氢原子没有画出)。
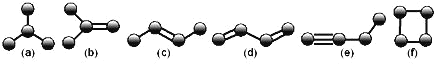
(1)写出有机物(a)的系统命名法的名称_____。
(2)有机物(e)有一种同类别的同分异构体,试写出其结构简式_____。
(3)上述有机物中与(c)互为同分异构体的是_____(填序号)。
(4)写一种与(b)互为同系物且所含碳原子数最少的有机物的结构简式_____。
(5)上述有机物中不能与溴水反应使其褪色的有_____(填序号)。
(6)写出有机物(d)反应生成高分子化合物的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com