
ЁОЬтФПЁПЃЈ1ЃЉЬњМАЬњЕФЛЏКЯЮягІгУЙуЗКЃЌШчFeCl3ПЩгУзїДпЛЏМСЁЂгЁЫЂЕчТЗЭАхИЏЪДМСКЭЭтЩЫжЙбЊМСЕШЁЃаДГіFeCl3ШмвКИЏЪДгЁЫЂЕчТЗЭАхЕФРызгЗНГЬЪН___ЁЃИЏЪДЭАхКѓЕФЛьКЯШмвКжаЃЌШєCu2+ЁЂFe3+КЭFe2+ЕФХЈЖШОљЮЊ0.10mol/LЃЌЧыВЮееЯТБэИјГіЕФЪ§ОнКЭвЉЦЗЃЌМђЪіГ§ШЅCuCl2ШмвКжаFe3+КЭFe2+ЕФЪЕбщВНжш___ЁЃ
ЧтбѕЛЏЮяПЊЪМГСЕэЪБЕФpH | ЧтбѕЛЏЮяГСЕэЭъШЋЪБЕФpH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
ЬсЙЉЕФвЉЦЗЃКCl2 ХЈH2SO4 NaOHШмвК CuO Cu | ||
ЃЈ2ЃЉМфНгЕчЛЏбЇЗЈПЩЖдДѓЦјЮлШОЮяNOНјааЮоКІЛЏДІРэЃЌЦфЙЄзїдРэШчЭМЫљЪОЃЌжЪзгФЄдЪаэH+КЭH2OЭЈЙ§ЁЃЕчМЋЂёЮЊ___МЋЃЌЕчМЋЗДгІЪНЮЊ___ЃЌЮќЪеЫўжаЕФЗДгІЮЊ____ЃЌУПДІРэ1molNOЃЌПЩЭЌЪБЕУЕН___gO2ЁЃ
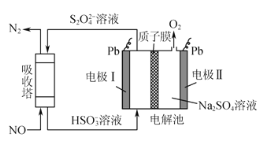
ЃЈ3ЃЉЁАжигЭ-бѕЦј-ШлШкЬМЫсФЦЁБШМСЯЕчГизАжУШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧЃЈ______ЃЉ
A.O2дкbМЋЕУЕчзгЃЌзюжеБЛЛЙдЮЊCO32-
B.ЗХЕчЙ§ГЬжаЃЌЕчзггЩЕчМЋaОЕМЯпСїЯђЕчМЋb
C.ИУЕчГиЙЄзїЪБЃЌCO32-ОЁАНЛЛЛФЄ2ЁБвЦЯђbМЋ
D.H2ВЮгыЕФЕчМЋЗДгІЮЊH2-2e-+CO32-=H2O+CO2
ЁОД№АИЁП2Fe3++Cu=2Fe2++Cu2+ ЂйЭЈШызуСПТШЦјНЋFe2+бѕЛЏГЩFe3+ЃЛЂкМгШыCuOЕїНкШмвКЕФpHжС3.2Љ4.7ЃЛЂлЙ§ТЫЃЈГ§ШЅFeЃЈOHЃЉ3ЃЉ вѕ 2HSO3-+2e-+2H+ЈTS2O42-+2H2O 2NO+2S2O42-++2H2O=N2+4HSO3- 16 C
ЁОНтЮіЁП
(1)Fe3+гаЧПбѕЛЏадЃЌФмАбН№ЪєЭбѕЛЏГЩЭРызгЃЛЯШНЋFe2+зЊЛЏГЩFe3+ЃЛдйИљОнЭМБэЬѕМўШмвКЕФpHжЕЃЌШ§МлЬњРызгГСЕэЭъШЋКѓЃЌНјааЙ§ТЫМДПЩЃЛ
(2)ЕчМЋIЮЊвѕМЋЃЌдђЕчМЋЂђЮЊбєМЋЃЌЕчНтГижабєРызгЯђвѕМЋвЦЖЏЃЌHSO3-дкЕчМЋIЩЯзЊЛЏЮДS2O42-ЃЌЙ§ГЬжаSЕФЛЏКЯМлНЕЕЭЃЌЕУЕНЕчзгЗЂЩњЛЙдЗДгІЃЌдђЕчМЋIЮЊвѕМЋЃЛЮќЪеЫўжаЭЈШыNOКЭS2O42-РызгЗДгІЃЌЩњГЩN2КЭHSO3-ЃЌОнДЫаДГіЗДгІЗНГЬЪНЃЛДІРэNOЪБЃЌВњЩњHSO3-НјШыЕчНтГиЃЌO2внГіЕчНтГиЃЌS2O42-СїГіЕчНтГиЃЌОнДЫМЦЫуЕчНтГиЕФжЪСПБфЛЏЃЛ
(3)ШМСЯЕчГиЭЈO2ЕФМЋЮЊе§МЋЃЌЗЂЩњЛЙдЗДгІЃЌШМСЯдкИКМЋЗЂЩњбѕЛЏЗДгІЃЛдЕчГиЙЄзїЪБЕчзгбиЕМЯпСїЯђе§МЋЃЌЕчГиФкВПвѕРызгЯђИКМЋвЦЖЏЁЃ
(1)Fe3+гаЧПбѕЛЏадЃЌФмАбН№ЪєЭбѕЛЏГЩЭРызгЃЌздЩэБЛЛЙдГЩ Fe2+ЃЌЗДгІЗНГЬЪНЮЊ2Fe3++Cu=2Fe2++Cu2+ЃЛИљОнЭМБэжЊЃЌFe3+ГСЕэашвЊЕФPHжЕНЯаЁЃЌгыЭРызгГСЕэЪБЕФPHжЕЯрВюНЯДѓЃЌЫљвдЪзЯШНЋЖўМлЬњРызгзЊЛЏЮЊШ§МлЬњРызгЃЌбЁШЁЕФЪдМСВЛФмв§НјаТЕФдгжЪРызгЃЌЫљвдбЁШЁТШЦј зїбѕЛЏМСЃЛШЛКѓМгШШбѕЛЏЭГ§ШЅТШЦјШмНтЩњГЩЕФбЮЫсЃЌдкPHжЕ3.2ЪБШ§МлЬњРызгЭъШЋГСЕэЃЌPHжЕ4.7ЪБЭРызгПЊЪМГСЕэЃЌЫљвдЕїНкШмвКЕФPHжЕжС3.2-4.7ЃЛШЛКѓЭЈЙ§Й§ТЫГ§ШЅЩњГЩЕФГСЕэЃЛ
(2)HSO3-дкЕчМЋIЩЯзЊЛЏЮДS2O42-ЃЌЙ§ГЬжаSЕФЛЏКЯМлНЕЕЭЃЌЕУЕНЕчзгЗЂЩњЛЙдЗДгІЃЌдђЕчМЋIЮЊвѕМЋЃЌЕчМЋЗДгІЮЊЃК2HSO3-+2e-+2H+ЈTS2O42-+2H2OЃЛЮќЪеЫўжаЭЈШыNOКЭS2O42-РызгЗДгІЃЌЩњГЩN2КЭHSO3-ЃЌЫљвдЗДгІЗНГЬЪНЮЊЃК2NO+2S2O42-+2H2O=N2+4HSO3-ЃЛЕчМЋЂђЮЊбєМЋЃЌH2OдкЕчМЋЂђЩЯБЛзЊЛЏЮЊO2ЃЌЗЂЩњЕчМЋЗДгІЃК2H2O-4e-ЈTO2Ёќ+4H+ЃЌУПДІРэ1molNOЃЌдђзЊвЦЕчзгЪ§ЮЊ1molЁС2=2molЃЌИљОнЕчзгзЊвЦЪиКуЃЌдђВњЩњO2ЕФЮяжЪЕФСПЮЊ2molЁС![]() =0.5molЃЌжЪСПЮЊ0.5molЁС32g/mol=16gЃЛ
=0.5molЃЌжЪСПЮЊ0.5molЁС32g/mol=16gЃЛ
(3)AЃЎбѕЦјвЛМЋЮЊе§МЋЃЌЗЂЩњЛЙдЗДгІЃЌЫљвдO2дкbМЋЕУЕчзгЃЌзюжеБЛЛЙдЮЊCO32-ЃЌЙЪAе§ШЗЃЛ
BЃЎдЕчГижаЕчзгбиЕМЯпСїЯђе§МЋЃЌЫљвдЗХЕчЙ§ГЬжаЃЌЕчзггЩЕчМЋaОЕМЯпСїЯђЕчМЋbЃЌЙЪBе§ШЗЃЛ
CЃЎдЕчГижавѕРызгЯђИКМЋвЦЖЏЃЌЫљвдCO32-ОЁАНЛЛЛФЄ2ЁБвЦЯђaМЋЃЌЙЪCДэЮѓЃЛ
DЃЎИКМЋЧтЦјЗЂЩњбѕЛЏЗДгІЃЌЕчМЋЗДгІЪНЃКH2-2e-+CO32-ЈTH2O+CO2ЃЌЙЪDе§ШЗЃЛ
ЙЪД№АИЮЊCЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈДэЮѓЕФЪЧ(ЁЁ)
A. ЫљгаЕФдзгЖМКЌгажЪзгЁЂжазгКЭЕчзгШ§жжЛљБОЙЙГЩЮЂСЃ
B. гюжцДѓБЌеЈВњЩњСЫЧтЁЂКЄЁЂяЎдЊЫи
C. ![]() зѓЭМЕФдзгФЃаЭЪЧВЃЖћЬсГіЕФ
зѓЭМЕФдзгФЃаЭЪЧВЃЖћЬсГіЕФ
D.  ФЃаЭжаЕФаЁКкЕуБэЪОЕчзгдкдзгКЫЭтГіЯжЕФИХТЪУмЖШЕФаЮЯѓУшЪі
ФЃаЭжаЕФаЁКкЕуБэЪОЕчзгдкдзгКЫЭтГіЯжЕФИХТЪУмЖШЕФаЮЯѓУшЪі
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЪЧФГМгЕтЪГбЮАќзАДќЩЯЕФВПЗжЭМБэЮФзж(IЮЊЕтдЊЫиЗћКХ)ЁЃгЩДЫЃЌФуЕУЕНЕФаХЯЂКЭзїГіЕФЭЦВтЪЧ( )

ТШЛЏФЦ (NaCl) | Ён98.0% (вдNaClМЦ) |
ЕтЫсМи (KIO3) | (35ЁР15)mg/kg (вдIМЦ) |
A.ДЫЪГбЮЪЧДПОЛЮя
B.ЁАМгЕтЪГбЮЁБжаЕФЁАЕтЁБЪЧжИЕЅжЪ
C.1kgДЫЪГбЮжаКЌЕтЫсМи(35ЁР15)mg
D.ВЫЮДЩеЪьВЛвЫМгШыМгЕтЕФдвђПЩФмЪЧЕтЫсМиЪмШШВЛЮШЖЈ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
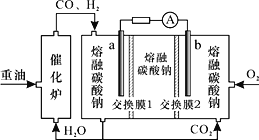
ЁОЬтФПЁПЮЂЩњЮяШМСЯЕчГидкОЛЛЏЗЯЫЎЕФЭЌЪБФмЛёЕУФмдДЛђЕУЕНгаМлжЕЕФЛЏбЇВњЦЗЃЌЭМ2ЮЊЦфЙЄзїдРэЃЌЭМ1ЮЊЗЯЫЎжаCr2O72-РызгХЈЖШгыШЅГ§ТЪЕФЙиЯЕЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. MЮЊЕчдДИКМЋЃЌгаЛњЮяБЛбѕЛЏ
B. ЕчГиЙЄзїЪБЃЌNМЋИННќШмвКpHдіДѓ
C. ДІРэ1 mol Cr2O72ЃЪБга6 mol HЃЋДгНЛЛЛФЄзѓВрЯђгвВрЧЈвЦ
D. Cr2O72ЃРызгХЈЖШНЯДѓЪБЃЌПЩФмЛсдьГЩЛЙдОњЪЇЛю
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
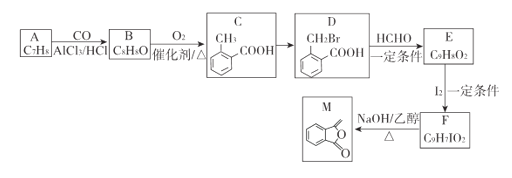
ЁОЬтФПЁПЛЏКЯЮяMЪЧжЦБИвЛжжПЙОњвЉЕФжаМфЬхЃЌЪЕбщЪввдЗМЯуЛЏКЯЮяAЮЊдСЯжЦБИMЕФвЛжжКЯГЩТЗЯпШчЯТЃК
вбжЊЃКR1CH2Br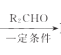 R1CH=CHR2
R1CH=CHR2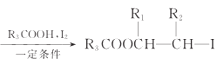
ЛиД№ЯТСаЮЪЬтЃК
(1)AЕФНсЙЙМђЪНЮЊ_______ЃЛBжаЙйФмЭХЕФУћГЦЮЊ_______ЃЛCЕФЛЏбЇУћГЦЮЊ_________ЁЃ
(2)гЩCЩњГЩDЫљашЕФЪдМСКЭЬѕМўЮЊ_______ЃЌИУЗДгІРраЭЮЊ____________.
(3)гЩFЩњГЩMЕФЛЏбЇЗНГЬЪНЮЊ__________________________________ЁЃ
(4)QЮЊMЕФЭЌЗжвьЙЙЬхЃЌТњзуЯТСаЬѕМўЕФQЕФНсЙЙга________жж(ВЛКЌСЂЬхвьЙЙ)ЃЌШЮаДГіЦфжавЛ.жжКЫДХЙВеёЧтЦзжага4зщЮќЪеЗхЕФНсЙЙМђЪН_________________ЁЃ
ЂйГ§БНЛЗЭтЮоЦфЫћЛЗзДНсЙЙ
ЂкФмЗЂЩњЫЎНтЗДгІКЭвјОЕЗДгІ
(5)ВЮееЩЯЪіКЯГЩТЗЯпКЭаХЯЂЃЌвдввЯЉКЭввШЉЮЊдСЯ(ЮоЛњЪдМСШЮбЁ)ЃЌЩшМЦжЦБИОл2-ЖЁЯЉЕФКЯГЩТЗЯп_____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђ1L0.1 molLЁЊl вЛдЊЫсHRШмвКжаж№НЅЭЈШыАБЦјЃлвбжЊГЃЮТЯТNH3 H2OЕчРыЦНКтГЃЪ§K = l .76x 10-5]ЃЌ ЪЙШмвКЮТЖШКЭЬхЛ§БЃГжВЛБфЃЌ ЛьКЯШмвКЕФpHгыРызгХЈЖШБфЛЏЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаа№Ъіе§ШЗЕФЪЧ
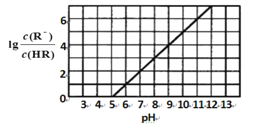
A.0. l molLЁЊ1HR ШмвКЕФpHЮЊ5
B.HRЮЊШѕЫсЃЌГЃЮТЪБЫцзХАБЦјЕФЭЈШыЃЌc(RЁЊ)/[c(OHЁЊ).c(HR)] ж№НЅдіДѓ
C.ЕБЭЈШы0.1 mol NH3ЪБЃЌc(NH4+ > c(RЁЊ)
D.ЕБc(RЁЊ )=c(HR)ЪБ ШмвКБиЮЊжаад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫФТШЛЏЮ§ЪЧвЛжжЮоЩЋгаЧПСвЕФДЬМЄадЦјЮЖЕФвКЬхЃЌгаИЏЪДадЃЌГЃгУзїУНШОМСКЭгаЛњКЯГЩЩЯЕФТШЛЏДпЛЏМСЁЃЙЄвЕЩЯГЃгУТШЦјгыН№ЪєЮ§Лђ SnCl2 РДжЦЕУЁЃФГЛЏбЇаЫШЄаЁзщАбИЩдяТШЦјЭЈШыШлШк SnCl2 2H2OжажЦШЁЮоЫЎSnCl4гаШчЭМЫљЪОЕФЯрЙизАжУЃК
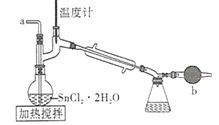
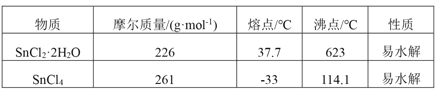
(1)ЪЂзАSnCl4ЕФШнЦїгІЬљЩЯЕФАВШЋОЏЪОБъЧЉЪЧ____________ЃЈЬюађКХЃЉЁЃ

(2)зАжУbЕФзїгУЪЧ______________________ ЁЃ
(3)ЮЊБмУт SnCl4 ЫЎНтЃЌЭЈCl2 ЧАгІЯШГ§ SnCl2 ЕФНсОЇЫЎЃЌЦфВйзїЪЧ_____________ЃЌдкГБЪЊПеЦјжа SnCl4 ЫЎНтВњЩњАзЩЋбЬЮэЃЌ ЦфЛЏбЇЗНГЬЪНЮЊ ________________ ЁЃ
(4)ИУбЇЯАаЁзщзюжежЦЕУЕФSnCl4 ГЪЛЦЩЋЃЌПЩФмЕФдвђЪЧ ______________________ЃЌШчЙћвЊГ§ШЅЛЦЩЋЕУЕНЮоЩЋВњЦЗЃЌФуЕФзіЗЈЪЧ ________________________ЁЃ
(5)ПЩвдЭЈЙ§ВтЖЈЪЃгрSnCl4 ЕФСПРДМЦЫуИУДЮЪЕбщЕФВњТЪЃЌ ЗНЗЈЪЧШУВаСєЕФSnCl4 гызуСПСђЫсЬњЯГЗДгІЃЌЦфжаFe3+БЛSn2+ЛЙдЮЊFe2+ЁЃ ШЛКѓдкСђЫсКЭСзЫсЛьКЯЬѕМўЯТЃЌвдЖўБНАЗЛЧЫсФЦзїжИЪОМСЃЌгУ K2Cr2O7 БъзМШмвКЕЮЖЈЩњГЩЕФFe2+Й§ГЬжаЕФРызгЗНГЬЪНЮЊ
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-ЃЋ____Fe2++ЃЈ______ЃЉ____ЃН_____Cr3++______Fe3++ЃЈ_____ЃЉ_____
ЂйЭъГЩВЂХфЦНЩЯЪіЗНГЬЪНbЁЃ
ЂквбжЊЖўБНАЗЛЧЫсФЦЛЙдЬЌЮЊЮоЩЋЃЌбѕЛЏЬЌЮЊзЯЩЋЃЌдђЕЮЖЈДяЕНжеЕуЕФЯжЯѓЪЧ____
ЂлШєЪЕбщЧАГЦШЁ 22.6g SnC12H2OОЇЬхгкЩеЦПжаЃЌЪЕбщНсЪјКѓЃЌЯђЩеЦПФкВаСєЮяжаЭЈШызуСПN2,ШЁЩеЦПФкВаСєЮяШмгкЫЎХфГЩ250mL ШмвКЃЌШЁ25mLгкзЖаЮЦПжаЃЌгУвдЩЯЗНЗЈЕЮЖЈЃЌЯћКФ0.0l 00mol/L K2Cr2O7БъзМШм20.00mL, дђ SnCl4ЕФВњТЪзюДѓжЕЮЊ__________ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщЮяжЪжаЃЌЮяжЪжЎМфЭЈЙ§вЛВНЗДгІОЭФмЪЕЯжШчЭМЫљЪОзЊЛЏЕФЪЧЃЈЁЁЁЁЃЉ
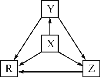
бЁЯю | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮТЖШЮЊTЪБЃЌЯђ2.0LКуШнУмБеШнЦїжаГфШы1.0mol PCl5ЃЌЗДгІPCl5ЃЈgЃЉPCl3ЃЈgЃЉ+Cl2ЃЈgЃЉ,ОЙ§вЛЖЮЪБМфКѓДяЕНЦНКтЁЃЗДгІЙ§ГЬжаВтЖЈЕФВПЗжЪ§ОнМћЯТБэЃК
t/s | 0 | 50 | 150 | 250 | 350 |
nЃЈPCl3ЃЉ/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A.ЗДгІдк50sЪБЕФЫйТЪvЃЈPCl3ЃЉЃН0.0016molLЉ1sЉ1
B.БЃГжЦфЫћЬѕМўВЛБфЃЌЩ§ИпЮТЖШЃЌЦНКтЪБcЃЈPCl3ЃЉЃН0.11molLЉ1ЃЌдђЗДгІЕФЁїHЃМ0
C.ЯрЭЌЮТЖШЯТЃЌЦ№ЪМЪБЯђШнЦїжаГфШы1.0molPCl5ЁЂ0.20molPCl3КЭ0.20molCl2ЃЌЗДгІДяЕНЦНКтЧАvЃЈе§ЃЉЃОvЃЈФцЃЉ
D.ЯрЭЌЮТЖШЯТЃЌЦ№ЪМЪБЯђШнЦїжаГфШы2.0molPCl3КЭ2.0molCl2ЃЌДяЕНЦНКтЪБЃЌPCl3ЕФзЊЛЏТЪаЁгк80%
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com