
【题目】常温下,向1L0.1 molL—l 一元酸HR溶液中逐渐通入氨气[已知常温下NH3 H2O电离平衡常数K = l .76x 10-5], 使溶液温度和体积保持不变, 混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
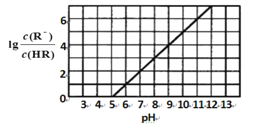
A.0. l molL—1HR 溶液的pH为5
B.HR为弱酸,常温时随着氨气的通入,c(R—)/[c(OH—).c(HR)] 逐渐增大
C.当通入0.1 mol NH3时,c(NH4+ > c(R—)
D.当c(R— )=c(HR)时 溶液必为中性
【答案】C
【解析】
A.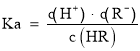 ,当
,当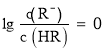 时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L;
时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L;
B. ,电离平衡常数、离子积常数都只与温度有关;
,电离平衡常数、离子积常数都只与温度有关;
C.当通入0.1molNH3时,反应恰好生成NH4R,NH4+的水解平衡常数为![]() ,HR水解平衡常数
,HR水解平衡常数![]() ,根据电荷守恒即NH4+和R的水解程度大小分析;
,根据电荷守恒即NH4+和R的水解程度大小分析;
D.当c(HR)=c(R)时,溶液的pH=5。
A.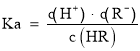 ,当
,当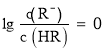 时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中
时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中![]() ,溶液的pH=3,故A错误;
,溶液的pH=3,故A错误;
B.  ,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则
,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则 不变,故B错误;
不变,故B错误;
C.当通入0.1molNH3时,反应恰好生成NH4R,NH4+的水解平衡常数为![]() ,HR水解平衡常数
,HR水解平衡常数![]() ,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH4+)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故C正确;
,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH4+)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故C正确;
D.当c(HR)=c(R)时,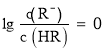 ,溶液的pH=5,溶液呈酸性,故D错误;
,溶液的pH=5,溶液呈酸性,故D错误;
故答案选:C。


科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中NO是主要成分之一。
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化学方程式____________________。

(2)FeSO4-Na2SO3复合吸收剂吸收烟气中的NO,该方法利用Fe2+易与NO发生络合反应的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如图是一段时间内不同吸收剂对NO脱除率对比,加入Na2SO3溶液后,吸收效率增强,除了Na2SO3也能吸收部分NO外,还能防氧化从而增大Fe2+的含量,写出此原理的离子方程式_______________________________________。

②模拟实验表明,温度过高或过低都会降低NO的脱除率,其原因是_______________________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成NO3-,原理如图

①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出NO发生反应的离子方程式____________________________。
③根据下图所示,脱NO过程中控制溶液pH在______________范围内更合理。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:

回答下列问题:
(1)“煅烧”可在_______(填仪器名称)中进行,主要反应的化学方程式为________;除“粉碎”外,还可以加快“煅烧”速率的措施有_________(只答一点即可)。
(2)实验室制取氧气。

①氧气的发生装置可以选择上图中的__________(填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→________(填小写字母);检验氧气已收集满的操作和现象为________。
(3)“酸浸”时,温度不能过高的原因为_______;若用盐酸代替双氧水、H2SO4的不足之处为____________;该步骤不能使用陶瓷容器的原因为___________________。
(4)“氧化”反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用溶液中离子平衡的相关知识,解决下列问题。
(1)含酚酞的0.01molL-1CH3COONa溶液显浅红色的原因为___(用离子方程式和必要文字解释)。
(2)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的某氨水溶液,滴定曲线如图所示。
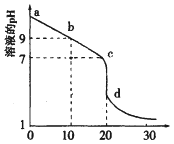
①d点所示的溶液中离子浓度由大到小的顺序依次为___。
②b点所示的溶液中c(NH3H2O)-c(NH4+)=___(用溶液中的其它离子浓度表示)。
③pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为___。
(3)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为___mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液=![]() ___(保留三位有效数字)。
___(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
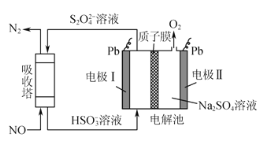
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
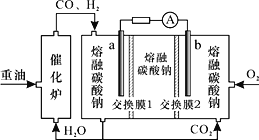
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学符号书写正确的是( )
A. 两个氢原子:H2 B. 镁的化合价+2价:Mg2+
C. 3个氧分子:3O2 D. 氯化钡的化学式:BaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:W、X、Y、Z、T 均为短周期元素,且原子半径依次增大。请填空:
(1)W、Z是形成化合物种类最多的两种元素,写出Z的核外电子的轨道表示式______________。
(2)化合物YW3溶于水能使酚酞变红,用方程式表示酚酞变红的原因____。
(3)元素T的原子中电子占据7根轨道,则T在元素周期表____周期___族;T的化合物TY熔融时不导电,常用作砂轮与耐高温材料,由此推知,它属于____。
a离子晶体b原子晶体c分子晶体d无法判断
(4)YX3与YW3具有相同的分子空间构型,YX3属于______(填“极性”、“非极性”)分子,其中Y的化合价为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com