
【题目】运用溶液中离子平衡的相关知识,解决下列问题。
(1)含酚酞的0.01molL-1CH3COONa溶液显浅红色的原因为___(用离子方程式和必要文字解释)。
(2)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的某氨水溶液,滴定曲线如图所示。
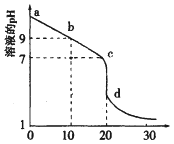
①d点所示的溶液中离子浓度由大到小的顺序依次为___。
②b点所示的溶液中c(NH3H2O)-c(NH4+)=___(用溶液中的其它离子浓度表示)。
③pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为___。
(3)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为___mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液=![]() ___(保留三位有效数字)。
___(保留三位有效数字)。
【答案】醋酸根离子水解结合水电离出的氢离子,CH3COO-+H2O![]() CH3COOH+OH-,促进水的电离平衡正向进行,溶液中氢氧根离子浓度增大,使溶液显碱性 (C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)﹣2c(OH-) 10-6 5.2×10-5 23.6
CH3COOH+OH-,促进水的电离平衡正向进行,溶液中氢氧根离子浓度增大,使溶液显碱性 (C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)﹣2c(OH-) 10-6 5.2×10-5 23.6
【解析】
(1)CH3COONa为强碱弱酸盐,水解呈碱性;
(2)①d点加入20mL盐酸后,两溶液恰好反应生成氯化铵,根据氯化铵溶液中离子浓度大小进行判断;
②b点加入了10mL盐酸,反应后的溶液中含有等浓度的氨水和氯化铵,一水合氨的电离程度大于铵根离子的水解,溶液显示碱性,溶液中出电荷守恒和物料守恒计算分析;
③常温下,pH=10的氨水溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-10mol/L;pH=4的NH4C1溶液中水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-4mol/L;
(3)①等体积混合后溶液中碳酸根的浓度为1×l0-4mol/L,利用溶度积计算需要钡离子浓度,再根据稀释定律计算所需BaCl2溶液的最小浓度;
②当碳酸钡、硫酸钡两种沉淀共存时,溶液中钡离子浓度为定值,根据溶度积计算。
(1)根据盐类水解的规律,无弱不水解,有弱才水解,越弱越水解,谁强显谁性,CH3COONa为强碱弱酸盐,水解呈碱性,遇酚酞变红,发生水解反应的离子方程式为CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
(2)①d点时加入20mL盐酸,两溶液恰好反应生成氯化铵,铵根离子水解溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知c(Cl- )>c(NH4+),则溶液中离子浓度大小为:c(Cl- )>c(NH4+)>c(H+)>c(OH-);
②b点加入的盐酸体积为氨水体积的![]() ,等浓度的两溶液反应后,混合液中含有等浓度的氨水和氯化铵,由于一水合氨的电离程度大于铵根离子的水解程度,则溶液显示碱性,溶液中出电荷守恒和物料守恒计算分析,电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-),c(NH4+)+c(NH3H2O)=2c(C1-),溶液中c(NH3H2O)-c(NH4+)=2 c(H+)-2c(OH-);
,等浓度的两溶液反应后,混合液中含有等浓度的氨水和氯化铵,由于一水合氨的电离程度大于铵根离子的水解程度,则溶液显示碱性,溶液中出电荷守恒和物料守恒计算分析,电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-),c(NH4+)+c(NH3H2O)=2c(C1-),溶液中c(NH3H2O)-c(NH4+)=2 c(H+)-2c(OH-);
③常温下,pH=10的氨水溶液中,水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-10mol/L;pH=4的NH4C1溶液中水电离出的氢氧根离子浓度等于水电离出的氢离子浓度=10-4mol/L,pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为=![]() =10-6;
=10-6;
(3)①等体积混合后溶液中碳酸根的浓度为2×l0-4mol/L×![]() =1×l0-4mol/L,要生成BaCO3沉淀需要钡离子浓度为
=1×l0-4mol/L,要生成BaCO3沉淀需要钡离子浓度为![]() mol/L=2.6×l0-5mol/L,故需要BaCl2溶液的最小浓度为2.6×l0-5mol/L×2=5.2×l0-5mol/L;
mol/L=2.6×l0-5mol/L,故需要BaCl2溶液的最小浓度为2.6×l0-5mol/L×2=5.2×l0-5mol/L;
②Ksp(BaSO4)=c(Ba2+)×(SO42-)=1.1×10-10;Ksp(BaCO3)=c(Ba2+)×c(CO32-)=2.6×10-9,则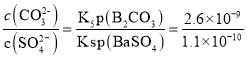 =23.6。
=23.6。


科目:高中化学 来源: 题型:
【题目】阿魏酸是传统中药当归、川穹的有效成分之一,工业上合成阿魏酸的原理如下,下列说法不正确的是
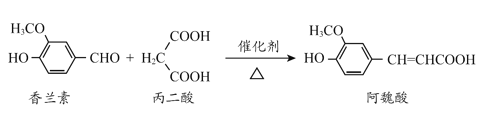 +H2O+CO2
+H2O+CO2
A.阿魏酸分子式为C10H10O4
B.阿魏酸存在顺反异构
C.方程式中三种有机物均可与NaOH、Na2CO3反应
D.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ下图为几种晶体或晶胞的示意图:
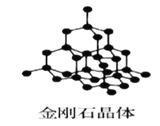
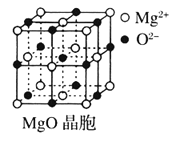
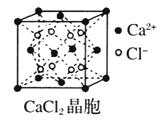

请回答下列问题:
(1)上述晶体中,粒子之间仅以共价键结合形成的晶体是____________。
(2)冰、金刚石、![]() 、
、![]() 、干冰5种晶体的熔点由高到低的顺序为_________________。
、干冰5种晶体的熔点由高到低的顺序为_________________。
(3)![]() 晶胞与
晶胞与![]() 晶胞相同,
晶胞相同,![]() 晶体的晶格能______(填“大于”或“小于”)
晶体的晶格能______(填“大于”或“小于”)![]() 晶体,原因是_________________。
晶体,原因是_________________。
(4)![]() 晶体中
晶体中![]() 的配位数为____________。
的配位数为____________。
(5)冰的熔点远高于干冰,除![]() 是极性分子、
是极性分子、![]() 是非极性分子外,还有一个重要的原因是__________________。
是非极性分子外,还有一个重要的原因是__________________。
Ⅱ(1)原子坐标参数可表示晶胞内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数![]() 、
、![]() ,则
,则![]() 原子的坐标参数为________________。
原子的坐标参数为________________。
(2)钾晶体的晶胞参数为![]() 。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____
。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____![]() ,晶体钾的密度计算式是_____
,晶体钾的密度计算式是_____![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是
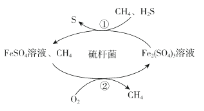
A.脱硫过程中Fe2(SO4)3溶液的pH逐渐减小
B.CH4是天然气脱硫过程的催化剂
C.脱硫过程需不断补充FeSO4
D.整个脱硫过程中参加反应的n(H2S):n(O2)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y 和 Z 的原子序数依次增大,W 的气态氢化物的水溶液使酚酞变红 并且可与X 的氢化物形成一种共价化合物。Y 是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子总数的 3/5。下列说法中一定正确的是
A.它们的简单离子半径大小顺序: W<X<Y<Z
B.X的简单气态氢化物稳定性比Z 的强
C.W的氧化物对应水化物为强酸,具有强氧化性
D.工业上一般采取电解Y 的熔融氯化物来生产Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1 molL—l 一元酸HR溶液中逐渐通入氨气[已知常温下NH3 H2O电离平衡常数K = l .76x 10-5], 使溶液温度和体积保持不变, 混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
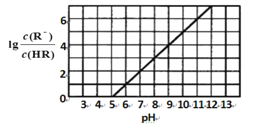
A.0. l molL—1HR 溶液的pH为5
B.HR为弱酸,常温时随着氨气的通入,c(R—)/[c(OH—).c(HR)] 逐渐增大
C.当通入0.1 mol NH3时,c(NH4+ > c(R—)
D.当c(R— )=c(HR)时 溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g) ![]() TiCl4(g)+CO2(g),在无水无氧条件下制取TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76 ℃、136 ℃,CCl4与TiCl4互溶)。下列说法正确的是
TiCl4(g)+CO2(g),在无水无氧条件下制取TiCl4,实验装置如图所示(CCl4、TiCl4的沸点分别为76 ℃、136 ℃,CCl4与TiCl4互溶)。下列说法正确的是
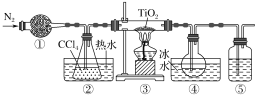
A.①、⑤分别盛装碱石灰、NaOH溶液
B.②中热水的作用是使CCl4汽化,④中冰水的作用是使TiCl4冷凝
C.③中反应结束后,先停止通N2,再停止加热
D.分离④中的液态混合物,采用的操作是分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com