
【题目】短周期主族元素W、X、Y 和 Z 的原子序数依次增大,W 的气态氢化物的水溶液使酚酞变红 并且可与X 的氢化物形成一种共价化合物。Y 是地壳中含量最多的金属元素,Z原子最外层电子数是其内层电子总数的 3/5。下列说法中一定正确的是
A.它们的简单离子半径大小顺序: W<X<Y<Z
B.X的简单气态氢化物稳定性比Z 的强
C.W的氧化物对应水化物为强酸,具有强氧化性
D.工业上一般采取电解Y 的熔融氯化物来生产Y的单质
【答案】B
【解析】
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,该氢化物为氨气,则W为N元素;并且可与X的氢化物形成一种共价化合物,生成一水合氨,则X为O元素;Y是地壳中含量最多的金属元素,则Y为Al元素;Z原子最外层电子数是其内层电子总数的![]() 则Z原子最外层含有6个电子,结合原子序数可知Z为S元素,据此进行解答。
则Z原子最外层含有6个电子,结合原子序数可知Z为S元素,据此进行解答。
短周期主族元素W、X、Y和Z的原子序数依次增大,W的气态氢化物的水溶液可使酚酞变红,该氢化物为氨气,则W为N元素;并且可与X的氢化物形成一种共价化合物,生成一水合氨,则X为O元素;Y是地壳中含量最多的金属元素,则Y为Al元素;Z原子最外层电子数是其内层电子总数的![]() 则Z原子最外层含有6个电子,结合原子序数可知Z为S元素,
则Z原子最外层含有6个电子,结合原子序数可知Z为S元素,
A. 电子层数越多半径越大,电子层数相同时核电荷越多半径越小,所以原子半径大小顺序:X<W<Z<Y,故A正确;
B. 非金属性越强对应氢化物越稳定,氧元素的非金属性强于硫,所以X的简单气态氢化物稳定性比Z的强,故B错误;
C.W的最高价氧化物对应水化物硝酸为强酸,具有强氧化性,故C错误;
D. 氯化铝是共价化合物,工业上一般采取电解Y的熔融氧化物来生产Y的单质,故D错误;
故答案选:A。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中正确的是
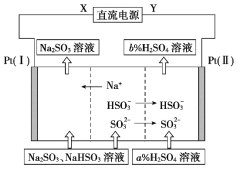
A.X应为直流电源的正极
B.电解过程中阴极区pH升高
C.图中的b%<a%
D.SO32-在电极上发生的反应为SO32-+2OH--2e-=SO42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 盐酸和氨水反应H++OH=H2O、B. 钠和冷水反应Na+2H2O=Na++2OH+H2↑
C. 氯气和氢氧化钠溶液反应Cl2+2OH=Cl+ClO+H2OD. 铜和稀硝酸反应Cu+2NO3+4H+=2Cu2++2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g![]() 的变化如右图所示。下列说法正确的是
的变化如右图所示。下列说法正确的是
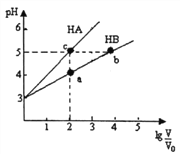
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用溶液中离子平衡的相关知识,解决下列问题。
(1)含酚酞的0.01molL-1CH3COONa溶液显浅红色的原因为___(用离子方程式和必要文字解释)。
(2)室温下,用0.100mol/L盐酸溶液滴定20.00mL0.100mol/L的某氨水溶液,滴定曲线如图所示。
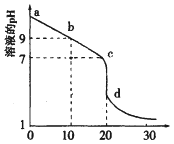
①d点所示的溶液中离子浓度由大到小的顺序依次为___。
②b点所示的溶液中c(NH3H2O)-c(NH4+)=___(用溶液中的其它离子浓度表示)。
③pH=10的氨水与pH=4的NH4C1溶液中,由水电离出的c(H+)之比为___。
(3)已知Ksp(BaCO3)=2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为___mol/L。
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液=![]() ___(保留三位有效数字)。
___(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图设计的串联电池装置,R为变阻器,以调节电路电流。
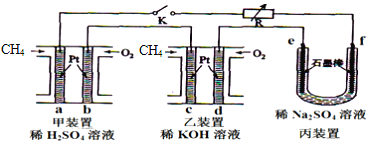
(1)写出b、c电极的电极反应式:b___,c___;
(2)写出f电极的电极反应式___,向此电极区域滴入酚酞的现象为:___;该电极区域水的电离平衡被___(填“促进”、“抑制”或“无影响”)。
(3)闭合K一段时间后,丙装置的电解质溶液pH___(填“变大”、“变小”或“不变”),原因是___。
(4)电解一段时间后丙装置析出芒硝(Na2SO410H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入___gH2O就可以将析出的沉淀溶解并恢复到原有浓度。
(5)有一硝酸盐晶体,其化学式为M(NO3)xyH2O,相对分子质量为242。取1.21g该晶体溶于水,配成100mL溶液,将此溶液用石墨作电极进行电解,当有0.0100mol电子发生转移时,溶液中金属全部析出。经称量阴极增重0.320g。则
①金属M的相对原子质量为___;
②电解后,生成气体体积=___(标准状况下)溶液的pH=___(电解过程中溶液体积变化忽略不计)。要求写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学符号书写正确的是( )
A. 两个氢原子:H2 B. 镁的化合价+2价:Mg2+
C. 3个氧分子:3O2 D. 氯化钡的化学式:BaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
R-CH=CH2+H2O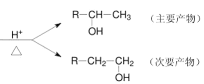
现以2-甲基丙烷为有机原料,配以其他必要的无机物原料,选择反应中的主要产物按以下流程合成产品:
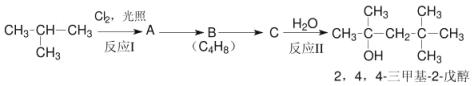
请回答:
(1)写出丙烯与氯化氢反应的主要产物的结构简式__________________;
(2)写出反应Ⅰ得到产物可能的结构简式__________________;
(3)写出反应类型:反应Ⅰ_________、反应Ⅱ_________;
(4)写出 A→B 的反应条件_____;B→C 的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2O2中加入MnO2,产生O2的速度加快
C.合成氨为提高NH3的产率,理论上应采取高压低温的条件
D.氨水应密闭保存、放置于低温处
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com