
【题目】氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:

回答下列问题:
(1)“煅烧”可在_______(填仪器名称)中进行,主要反应的化学方程式为________;除“粉碎”外,还可以加快“煅烧”速率的措施有_________(只答一点即可)。
(2)实验室制取氧气。

①氧气的发生装置可以选择上图中的__________(填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→________(填小写字母);检验氧气已收集满的操作和现象为________。
(3)“酸浸”时,温度不能过高的原因为_______;若用盐酸代替双氧水、H2SO4的不足之处为____________;该步骤不能使用陶瓷容器的原因为___________________。
(4)“氧化”反应的化学方程式为_________________________________。
【答案】坩埚 4CeFCO3+O2![]() 3CeO2+CeF4+4CO2 适当升高煅烧温度等 B cdgf(或dcgf) 将带有火星的木条置于f口,木条复燃 会导致H2O2分解而降低原料的利用率 HCl被氧化为Cl2,污染环境 生成的HF腐蚀陶瓷 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
3CeO2+CeF4+4CO2 适当升高煅烧温度等 B cdgf(或dcgf) 将带有火星的木条置于f口,木条复燃 会导致H2O2分解而降低原料的利用率 HCl被氧化为Cl2,污染环境 生成的HF腐蚀陶瓷 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
【解析】
将氟碳铈矿粉碎后与O2在坩埚中高温煅烧,反应产生CeO2、CeF4、CO2,然后将CeO2、CeF4用硫酸浸取,同时加入H2O2溶液,可以将CeO2、CeF4与硫酸反应产生的Ce4+还原为Ce3+,向该溶液中加入适量NaOH溶液反应产生Ce(OH)3,然后再向该悬浊液中加入氧化剂NaClO,发生氧化还原反应产生Ce(OH)4。
(1)高温“煅烧”可在坩埚中进行;CeFCO3高温条件下与O2反应生成CeO2、CeF4、CO2,根据电子守恒、原子守恒,可得该反应的反应方程式为4CeFCO3+O2![]() 3CeO2+CeF4+4CO2。除“粉碎”外,还可以加快“煅烧”速率的措施有适当增大O2的压强、适当升高煅烧温度等;
3CeO2+CeF4+4CO2。除“粉碎”外,还可以加快“煅烧”速率的措施有适当增大O2的压强、适当升高煅烧温度等;
(2)①用双氧水与MnO2或Na2O2与H2O反应制备O2可选择装置B装置,故合理选项是B;
②选用B装置制备O2,用C干燥O2,E用于收集O2,故装置的连接顺序为bcd(或dc)gf;检验O2收集满的操作和现象为:将带火星的木条置于f口,木条复燃,则O2已经收集满;
(3) H2O2不稳定,受热易分解,所以“酸浸”时,温度不易过高,否则会导致H2O2分解,降低原料的利用率;若用盐酸代替,Ce4+会将HCl被氧化为Cl2,导致污染环境;该步骤有HF生成,由于HF与陶瓷中的SiO2会反应,故不能使用陶瓷容器;
(4) “氧化”时NaClO在碱性条件下将Ce(OH)3氧化为Ce(OH)4,反应的化学方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
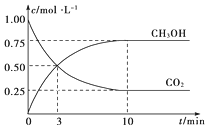
A.欲增大平衡状态时![]() 的比值,可采用升高温度的方法
的比值,可采用升高温度的方法
B.3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式正确的是
A. 明矾做净水剂:Al3++ 3H2O = Al (OH)3↓+ 3H+
B. 小苏打治疗胃酸过多:CO32-+ 2H+= CO2↑+ H2O
C. 漂白液加白醋,提高漂白效率:CH3COOH + ClO-=HClO + CH3COO-
D. 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+ O2+2H2O= 2I2+ 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
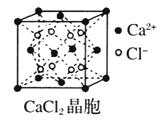
【题目】Ⅰ下图为几种晶体或晶胞的示意图:
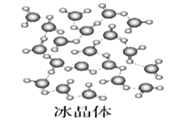
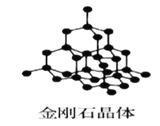
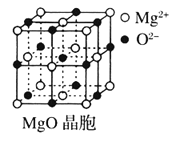

请回答下列问题:
(1)上述晶体中,粒子之间仅以共价键结合形成的晶体是____________。
(2)冰、金刚石、![]() 、
、![]() 、干冰5种晶体的熔点由高到低的顺序为_________________。
、干冰5种晶体的熔点由高到低的顺序为_________________。
(3)![]() 晶胞与
晶胞与![]() 晶胞相同,
晶胞相同,![]() 晶体的晶格能______(填“大于”或“小于”)
晶体的晶格能______(填“大于”或“小于”)![]() 晶体,原因是_________________。
晶体,原因是_________________。
(4)![]() 晶体中
晶体中![]() 的配位数为____________。
的配位数为____________。
(5)冰的熔点远高于干冰,除![]() 是极性分子、
是极性分子、![]() 是非极性分子外,还有一个重要的原因是__________________。
是非极性分子外,还有一个重要的原因是__________________。
Ⅱ(1)原子坐标参数可表示晶胞内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数![]() 、
、![]() ,则
,则![]() 原子的坐标参数为________________。
原子的坐标参数为________________。
(2)钾晶体的晶胞参数为![]() 。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____
。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为_____![]() ,晶体钾的密度计算式是_____
,晶体钾的密度计算式是_____![]() 。
。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料和燃料,常含有少量H2S。一种在酸性介质中进行天然气脱硫的原理示意图如图所示。下列说法正确的是
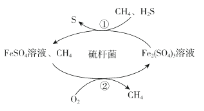
A.脱硫过程中Fe2(SO4)3溶液的pH逐渐减小
B.CH4是天然气脱硫过程的催化剂
C.脱硫过程需不断补充FeSO4
D.整个脱硫过程中参加反应的n(H2S):n(O2)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图2为其工作原理,图1为废水中Cr2O72-离子浓度与去除率的关系。下列说法不正确的是

A. M为电源负极,有机物被氧化
B. 电池工作时,N极附近溶液pH增大
C. 处理1 mol Cr2O72-时有6 mol H+从交换膜左侧向右侧迁移
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1 molL—l 一元酸HR溶液中逐渐通入氨气[已知常温下NH3 H2O电离平衡常数K = l .76x 10-5], 使溶液温度和体积保持不变, 混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
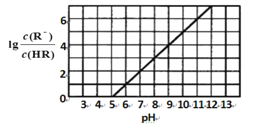
A.0. l molL—1HR 溶液的pH为5
B.HR为弱酸,常温时随着氨气的通入,c(R—)/[c(OH—).c(HR)] 逐渐增大
C.当通入0.1 mol NH3时,c(NH4+ > c(R—)
D.当c(R— )=c(HR)时 溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.Fe(OH)3溶于稀 H2SO4 中:H++OH﹣→H2O
B.氨水滴入AlCl3溶液中:Al3++3OH﹣→Al(OH)3↓
C.FeO溶于稀HCl中:O2﹣+2H+→H2O
D.铝溶解在NaOH溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com