
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216.4kJ/mol
b.CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=_____________kJ/mol
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。
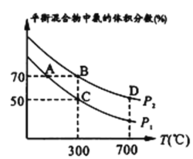
①恒压时,反应一定达到平衡状态的标志是__________ (填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C.![]() 比值保持不变
比值保持不变
D.![]() =2
=2
②P1________P2(填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点______D点;
③C点H2的转化率_______________;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A)_______v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式_____________________________________________。
②当转移电子量为0.3NA时,标况下消耗NH3____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: ![]()
![]()
![]() ?
?![]() ?
?![]() ,反应一段时间后达到平衡,测得生成
,反应一段时间后达到平衡,测得生成![]() ,且反应的前后压强之比为
,且反应的前后压强之比为![]() 相同的温度下测量
相同的温度下测量![]() ,则下列说法正确的是
,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=c(C)4c(D)2/c(A)3c(B
B.此时,B的平衡转化率是![]()
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种常见有机物的转化关系,下列说法正确的是

A. 反应①是加成反应,反应⑧是消去反应,其他所标明的反应都是取代反应
B. 上述物质中能与NaOH溶液反应的只有乙酸
C. 1,2-二溴乙烷、乙烯、乙醇烃基上的氢原子被氯原子取代,其一氯取代产物都是一种
D. 等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是
时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是

A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积扩大为1L,平衡向正反应方向移动
C.![]() 时,该反应的化学方程式为:
时,该反应的化学方程式为:![]() ,平衡常数
,平衡常数![]()
D.![]() 时,若起始时X与Y均为
时,若起始时X与Y均为![]() ,则平衡时Y的转化率小于
,则平衡时Y的转化率小于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) ![]() H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=__________。
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为________,HI的分解率为_________。
(2)在一定条件下,A气体与B气体反应生成C气体,反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
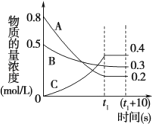
①该反应的化学方程式为:______________
②t1 s时反应物A的转化率为:__________
③0~t1 s内A的反应速率为v(A)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
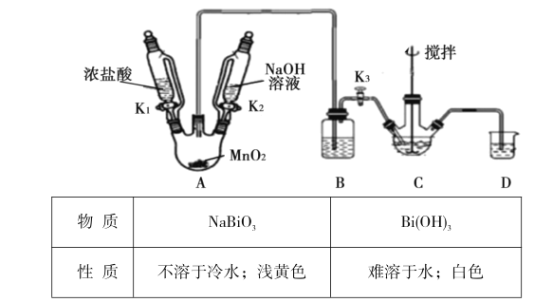
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,将
时,将![]()
![]() 气体充入2L密闭容器中,发生下列反应:
气体充入2L密闭容器中,发生下列反应:![]() ,每隔一段时间对该容器的物质进行测量,得到的数据如表:下列说法中正确的是
,每隔一段时间对该容器的物质进行测量,得到的数据如表:下列说法中正确的是
时间 | 0 | 20 | 40 | 60 | 80 |
|
|
|
|
|
|
|
|
|
|
|
|
A.反应开始20s内![]() 的平均反应速率是
的平均反应速率是![]()
![]()
B.80s时混合气体的颜色与60s时颜色相同,比40s时的颜色深
C.80s时向容器内加![]() molHe,容器体积保持不变,化学反应速率加快
molHe,容器体积保持不变,化学反应速率加快
D.80s时升高温度,则正反应速率加快,逆反应速率也加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2g铜投入100mL 14mol/L浓HNO3 溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96L。计算:
(1)所得气体的质量_____
(2)向反应后的溶液中加入多少毫升10mol/L NaOH溶液才能使Cu2+完全沉淀?____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com