
【题目】19.2g铜投入100mL 14mol/L浓HNO3 溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96L。计算:
(1)所得气体的质量_____
(2)向反应后的溶液中加入多少毫升10mol/L NaOH溶液才能使Cu2+完全沉淀?____
【答案】16.8g 60
【解析】
本题考核Cu和浓硝酸的反应,反应中涉及两个反应:Cu和浓硝酸反应生成硝酸铜和二氧化氮和水,随着反应的进行,浓硝酸变成稀硝酸,继续与Cu反应,生成硝酸铜、一氧化氮和水。
(1)在上述反应过程中,Cu原子失去电子,变为Cu2+,NO3-中的N原子得到电子,被还原为NO2、NO,根据反应过程中电子得失守恒以及NO、NO2的物质的量的关系进行求解。
(2)向反应后的溶液中加入NaOH溶液使Cu2+转化为Cu(OH)2沉淀,可根据Cu(OH)2中Cu2+与OH-的量的关系进行求解。
(1)收集到标准状况下气体的物质的量为:![]()
设收集到的气体中NO2的物质的量为x,NO的物质的量为y,据题意有:
![]()
Cu原子失去电子,变为Cu2+,NO3-中的N原子得到电子,被还原为NO2、NO,根据电子得失守恒有:![]() ,即
,即![]()
联立方程组,得:
![]() 解得:
解得:![]()
故所得气体的质量=![]()
答案为:16.8g。
(2)向反应后的溶液中加入NaOH溶液使Cu2+转化为Cu(OH)2沉淀,在Cu(OH)2中Cu2+的物质的量与OH-的物质的量的关系为:![]() ,则NaOH的体积为:
,则NaOH的体积为:![]() 。故向反应后的溶液中加入60毫升10mol/L NaOH 溶液才能使Cu2+完全沉淀。答案为:60。
。故向反应后的溶液中加入60毫升10mol/L NaOH 溶液才能使Cu2+完全沉淀。答案为:60。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热⑥将稀硫酸换为
固体;④加入少量水;⑤加热⑥将稀硫酸换为![]() 的硫酸,其中可提高
的硫酸,其中可提高![]() 的生成速率的措施有
的生成速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A+a B![]() C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的![]() H增大
H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
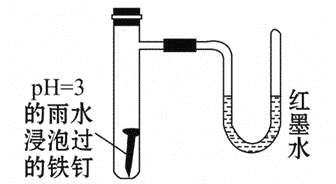
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
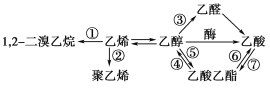
A. 只有反应③是氧化反应B. 反应①是消去反应
C. 只有反应②是加成聚合反应D. 反应④⑤⑥⑦是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如图:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的离子方程式是_________________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
ⅰ:2Fe2++PbO2+4H++SO![]() ===2Fe3++PbSO4+2H2O
===2Fe3++PbSO4+2H2O
ⅱ:……
①写出ⅱ的离子方程式:_______________________________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b._________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(VI)是主要污染物,可采用多种方法处理将其除去,查阅资料可知: 常温下,部分阳离子以氢氧化物形式沉淀时溶液的 pH 如下表:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的 pH | 1.9 | 7.0 | 4.3 |
沉淀完全的 pH | 3.2 | 9.0 | 5.6 |
I.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原 Cr(VI)。下列关于铁屑的说法中正确的是______________(填字母序号)。
a.作原电池的正极 b.在反应中作还原剂 c.铁屑生成 Fe3+可以进一步还原![]()
II.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。装置如下图所示。

(2)B极连接电源的___________极;
(3)电解开始时,B 极上主要发生的电极反应为2H++2e-= H2↑,此外还有少量![]() 在B极上直接放电,该反应的电极反应式为 _______________。
在B极上直接放电,该反应的电极反应式为 _______________。
(4)①酸性环境可以促使![]() 到
到![]() 的转化,写出对应的离子方程式:__________________;
的转化,写出对应的离子方程式:__________________;
②写出酸性环境中 Fe2+还原![]() 的离子方程式_______________________。
的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+BC与反应CA+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)2C(g)的平衡常数表达式为K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置 于密闭的窗口中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:![]() △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应:![]()
D.钢铁腐蚀时可能发生的正极反应:2H2O+ O2+ 4e-=4OH一
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com