
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法正确的是( )
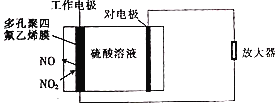
A.“对电极”是正极
B.“工作电极”上发生的电极反应为NO2+2H+-2e﹣═NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
科目:高中化学 来源: 题型:
【题目】四氯化锡是一种无色有强烈的刺激性气味的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂。工业上常用氯气与金属锡或 SnCl2 来制得。某化学兴趣小组把干燥氯气通入熔融 SnCl2 2H2O中制取无水SnCl4有如图所示的相关装置:
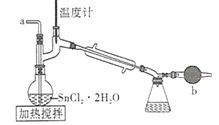
(1)盛装SnCl4的容器应贴上的安全警示标签是____________(填序号)。

(2)装置b的作用是______________________ 。
(3)为避免 SnCl4 水解,通Cl2 前应先除 SnCl2 的结晶水,其操作是_____________,在潮湿空气中 SnCl4 水解产生白色烟雾, 其化学方程式为 ________________ 。
(4)该学习小组最终制得的SnCl4 呈黄色,可能的原因是 ______________________,如果要除去黄色得到无色产品,你的做法是 ________________________。
(5)可以通过测定剩余SnCl4 的量来计算该次实验的产率, 方法是让残留的SnCl4 与足量硫酸铁铣反应,其中Fe3+被Sn2+还原为Fe2+。 然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用 K2Cr2O7 标准溶液滴定生成的Fe2+过程中的离子方程式为
a.Sn2++2Fe3+=2Fe2++Sn4+
b.Cr2O72-+____Fe2++(______)____=_____Cr3++______Fe3++(_____)_____
①完成并配平上述方程式b。
②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是____
③若实验前称取 22.6g SnC12H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL 溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0l 00mol/L K2Cr2O7标准溶20.00mL, 则 SnCl4的产率最大值为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测、实验设计、仪器使用能达到目的的是( )
A.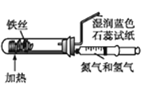 模拟工业制氨气检验产物
模拟工业制氨气检验产物
B.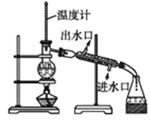 分离沸点不同的两种液体
分离沸点不同的两种液体
C.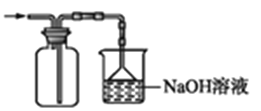 收集并吸收多余的氯气
收集并吸收多余的氯气
D. 盛放浓硝酸
盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是

A. Kal(H2X)的数量级为10-7
B. 曲线N表示lg 与pH的变化关系
与pH的变化关系
C. NaHX溶液中:c(H+)<c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—空气电池充放电基本原理如图所示,电池装置中间用高分子隔膜隔开,下列说法不正确的是( )
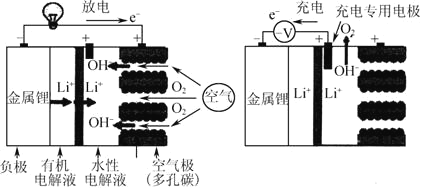
A.充电时,锂离子向阴极移动
B.充电时阴极电极反应式为Li++e- = Li
C.放电时正极电极反应式为O2+4e-+2H2O = 4OH-
D.电池装置中高分子隔膜允许水分子自由移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
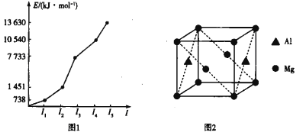
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:
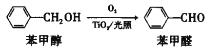
①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
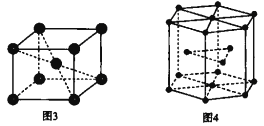
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
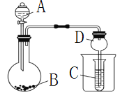
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的SO2。某同学设计下列实验以确定混合气体中含有乙烯和SO2。
(1)(I)、(Ⅱ)、(Ⅲ)、(Ⅳ)中盛放的试剂分别是________(可重复使用,填字母)。
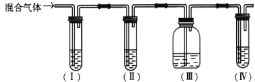
A.品红溶液 B. NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是_________________。
(3)使用装置Ⅱ的目的是_________________。
(4)使用装置Ⅲ的目的是_________________。
(5)确定含有乙烯的现象是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com