
| A. | 生活中的“增铁酱油”中的铁指的是铁元素 | |
| B. | 纯铁熔点比生铁的低,纯铁比生铁易生锈 | |
| C. | 与同浓度的盐酸反应,生铁速度快 | |
| D. | Fe是一种常见的黑色重金属均有多种变价 |
分析 A.“增铁酱油”加入的是EDTA铁;
B.生铁为Fe的合金,熔点比其各成分低,易形成原电池;
C.生铁含有杂质碳,铁和碳在表面电解质溶液中形成原电池反应能加快反应速率分析;
D.铁铬锰为黑色金属,其他为有色金属,铁为变价金属;
解答 解:A.生活中的“增铁酱油”中的铁为铁元素,故A正确;
B.纯铁比生铁的熔点高,不易被腐蚀,而生铁易腐蚀,故B错误;
C.杂质和铁会形成微小的原电池,铁更容易失去电子,所以比纯铁与盐酸反应速率快,故C错误;
D.Fe是一种常见的黑色金属有多种变价如+2、+3、+6等,不是重金属,故D错误;
故选A.
点评 本题考查了铁及其化合物性质应用、合金、原电池原理、黑色金属和重金属等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
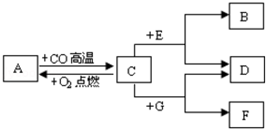 现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,C、F是最常见的金属,B是气体单质,D为FeSO4溶液,G为CuSO4溶液,它们之间存在如图所示关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Cu2+、I-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 使石蕊试液变蓝色的溶液:Mg2+、K+、SO 42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25.0g CuSO4•5H2O溶于蒸馏水配成100mL溶液 |
| B | 测定混有Na2CO3的NaCl固体样品中NaCl的质量分数 | 取m1 g样品加入过量盐酸充分反应,加热蒸干后,称量固体质量为m2 g |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 验证氧化性:H2O2比Fe3+强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 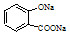 溶液通入少量CO2: 溶液通入少量CO2: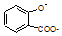 +CO2+H2O═ +CO2+H2O═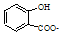 +HCO3- +HCO3- | |
| B. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3-可能会大量共存 | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+OH-=SO42-+Cl-+H+ | |
| D. | 5.6 g Fe与200 mL 2.0 mol/L HNO3溶液:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用托盘天平称量25.20g NaCl | |
| D. | 用25mL碱式滴定管量取碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
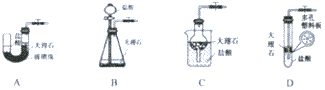
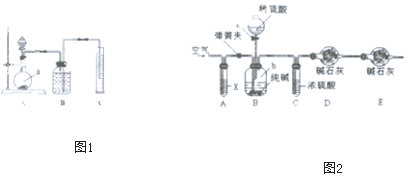
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com