
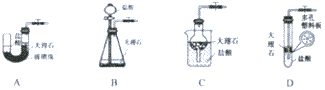
分析 Ⅰ、装置A中用弹簧夹夹住橡胶管时气体排不出去,反应容器中的气体压强变大从而迫使稀盐酸与大理石分离,反应停止;放开弹簧夹时,稀盐酸与大理石接触,发生化学反应生成二氧化碳;
Ⅱ、方案一:分离固液混合物的方法为过滤;洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,重复操作2-3次;
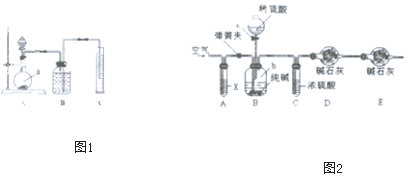
方案二:把一定量的混合物与足量硫酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;根据装置图分析;
方案三:(1)实验操作太快,则二氧化碳不能完全被碱石灰吸收;
(2)X的作用是吸收空气中的二氧化碳;
(3)空气中的二氧化碳和水蒸气进入D中会影响实验;
(4)分析实验前后装置D质量变化,并由此质量差计算样品中碳酸钠的质量,求出样品中碳酸钠的质量分数.
解答 解:Ⅰ、装置A用弹簧夹夹住橡胶管时气体排不出去,反应容器中的气体压强变大从而迫使稀盐酸与大理石分离,反应停止;放开弹簧夹时,稀盐酸与大理石接触,发生化学反应生成二氧化碳;
装置B中大理石与盐酸无法完全分离,所以不能达到随用随停,故不符合;
装置C中用弹簧夹夹住橡胶管时气体排不出去,球形瓶中的气体压强变大从而迫使稀盐酸排出干燥管并与大理石分离,反应停止.放开弹簧夹时,稀盐酸进入干燥管,并和烧杯中的液面相平同时与大理石接触,发生化学反应.所以该装置可以通过控制弹簧夹来达到使盐酸和大理石分离,从而控制反应的发生和停止,故符合;
装置D中大理石与盐酸无法分离,所以不能达到随用随停,故不符合;
故答案为:C;
II、方案一:样品溶解后加入过量的CaCl2溶液会生成碳酸钙沉淀,分离固液混合物的方法为过滤,洗涤沉淀的操作是沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复操作2-3次;
故答案为:过滤;沿玻璃棒缓慢地向过滤器中加蒸馏水至浸没沉淀物,使水自然流下,重复2~3次;
方案二:把一定量的样品与足量硫酸反应后,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积,在饱和碳酸氢钠溶液中二氧化碳不反应,溶解度最小,所以B中的溶液最好采用饱和NaHCO3溶液;由装置图可知下图装置中实验仪器a为圆底烧瓶;
故答案为:饱和NaHCO3溶液;圆底烧瓶;
方案三:(1)反应过快会使产生的气体二氧化碳没能完全被D装置中碱石灰吸收;快速鼓入空气,也会使装置内残留二氧化碳不能被D装置中碱石灰完全吸收;则测得的二氧化碳质量偏小,所以测定结果偏小;
故答案为:偏小;
(2)鼓入空气,可把残留在装置B、C中二氧化碳全部由D中碱石灰吸收,因为空气中含有二氧化碳,因此应把鼓入的空气中的二氧化碳吸收处理,所以装置A应放入氢氧化钠溶液;
故答案为:NaOH溶液;
(3)如果D装置直接与外界空气相连通,则空气中的水和二氧化碳会对测定结果带来影响,所以装置E的作用则是防止空气中水和二氧化碳进入装置D中;
故答案为:防止空气中CO2和水蒸气进入D中;
(4)反应中放出二氧化碳气体的质量=85.6g-83.4g=2.2g
设放出2.2g二氧化碳消耗碳酸钠的质量为x
Na2CO3~CO2
106 44
x 2.2g
$\frac{106}{x}$=$\frac{44}{2.2g}$,解得 x=5.3g
纯碱样品Na2CO3的质量分数=$\frac{5.3g}{6g}$×100%≈88.3%
故答案为:88.3%.
点评 本题考查了物质含量的测定、物质性质的探究和实验基本操作,主要是实验过程的分析,掌握基本操作是解题关键,题目难度中等,测定二氧化碳质量时注意空气中的成分对实验的影响.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 生活中的“增铁酱油”中的铁指的是铁元素 | |
| B. | 纯铁熔点比生铁的低,纯铁比生铁易生锈 | |
| C. | 与同浓度的盐酸反应,生铁速度快 | |
| D. | Fe是一种常见的黑色重金属均有多种变价 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量铜粉再过滤的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 向某无色未知溶液中加入氯化钡溶液,以检验溶液中SO42-的存在 | |
| C. | 将CO2 通入盛饱和NaOH溶液的洗气瓶可除去混有的HCl气体 | |
| D. | 只用紫色石蕊试剂和氯化钡溶液,不能将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA | |
| C. | 常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| D. | 标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素的一个分子中含有42个原子 | |
| B. | 青蒿素属于无机物 | |
| C. | 青蒿素的相对分子质量为282 | |
| D. | 青蒿素中碳元素的质量分数约为63.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 生成物的总焓大于反应物的总焓时,反应放热,△H<0 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1 NA | |
| B. | 常温常压下,22.4LCO2中含有的CO2分子数小于NA个 | |
| C. | 等物质的量的N2和CO的质量均为28g | |
| D. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com