
| A. | m+n<p | B. | C气体的体积分数增大 | ||
| C. | 平衡向正反应方向移动 | D. | B的转化率减小 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
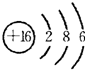 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1的AlCl3溶液 | B. | 20 mL 0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30 mL 0.2 mol•L-1的KCl溶液 | D. | 100 mL 0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

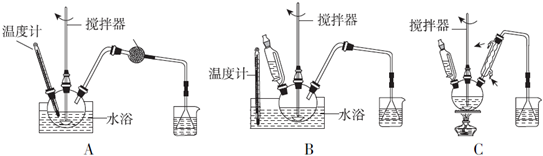
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
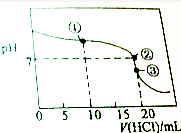 常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )| A. | 该氨水的浓度0.1000mol•L-1 | |
| B. | 点①溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=2c(Cl-) | |
| C. | 点②溶液中c(NH4+)=c(Cl-) | |
| D. | 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B与A只能组成BA3化合物 | |
| B. | 第三周期中,D原子的原子半径最大 | |
| C. | A、B、C三元素不可能形成离子化合物 | |
| D. | E的氧化物对应水化物一定有强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>C>B>D | B. | 原子半径:B>D>C>A | ||
| C. | 原子序数:C>B>D>A | D. | 简单离子半径:D>B>C>A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com