
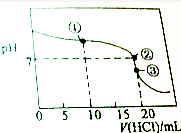
 常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )
常温下,用0.1000mol•L-1的盐酸滴定20.00mL未知浓度的氨水,滴定曲线如图所示,滴加20.00mL盐酸时所得溶液中,c(Cl-)=c(NH4+)+c(NH3•H2O)+c(NH3),下列说法错误的是( )| A. | 该氨水的浓度0.1000mol•L-1 | |
| B. | 点①溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=2c(Cl-) | |
| C. | 点②溶液中c(NH4+)=c(Cl-) | |
| D. | 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
分析 A.根据图象可知,加入20mL盐酸时出现滴定飞跃,说明氨水与盐酸的浓度相等,都是0.1000mol/L;
B.滴入10mL盐酸时,反应后溶质为等浓度的HCl和氯化铵,根据物料守恒判断;
C.点②时溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒判断铵根离子和氯离子浓度;
D.点③时两溶液恰好反应,溶质为氯化铵,铵根离子部分水解,溶液呈酸性,由于水解程度较小,则c(NH4+)>c(H+).
解答 解:A.由图象曲线变化可知,加入20mL盐酸时出现滴定飞跃,说明氨水与盐酸的浓度相等,所以该氨水的物质的量浓度为0.1000mol/L,故A正确;
B.点①时滴入10mL盐酸,由于盐酸与氨水浓度相等,反应后溶质为等浓度的氯化氢和氨水,根据物料守恒可知:c(NH4+)+c(NH3•H2O)+c(NH3)=2c(Cl-),故B正确;
C.点②时溶液为中性,则c(H+)=c(OH-),根据溶液中的电荷守恒可知:c(NH4+)=c(Cl-),故C正确;
D.点③时氨水和氯化氢恰好完全反应,反应后溶质为氯化铵,铵根离子部分水解,溶液呈酸性,由于水解程度较小,则c(Cl-)>c(NH4+)、c(H+)>c(OH-),由于水解程度较小,则c(NH4+)>c(H+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | C气体的体积分数增大 | ||
| C. | 平衡向正反应方向移动 | D. | B的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定含有分子间作用力,但不一定含有共价键 | |
| B. | 离子晶体中一定含有离子键,但不一定含有共价键 | |
| C. | 原子晶体中一定含有共价键,硬度大,熔沸点高 | |
| D. | 原子晶体都不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合Na、Al、Fe的有关性质,回答下列问题.
结合Na、Al、Fe的有关性质,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu→CuSO4 | B. | C→CO2 | C. | CuO→CuSO4 | D. | Fe2O3→Fe2(SO4)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制饱和氯水中:Na+、Al3+、SO32-、SO42- | |
| B. | 加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| C. | 常温下,在碱性的溶液中:K+、AlO2-、CO32-、Na+ | |
| D. | 在碱性的溶液中:K+、NH4+、AlO2-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com